
| 1 |
| 8 |
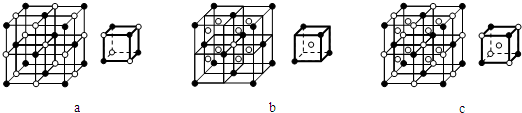
| 1 |
| 8 |
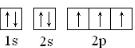 ,
, ;
;| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 8 |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4L酒精含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA |
| C、11.2 L H2所含的电子数为NA |
| D、通常状况下,NA个CO2分子含有原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
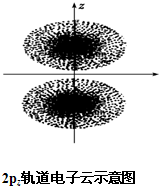 如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )
如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )| A、2pz轨道上的电子在空间出现的概率分布是z轴对称 |
| B、点密集的地方表明电子出现的机会多 |
| C、电子先沿z轴正半轴运动,然后在负半轴运动 |
| D、2pz轨道形状为两个椭圆球 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+Ag+ Ba 2+ A13+Fe3+ |
| 阴离子 | OH - C1- SO42-NO3- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
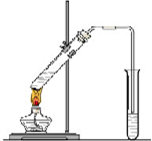 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com