
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制三氯化铬的流程如下:
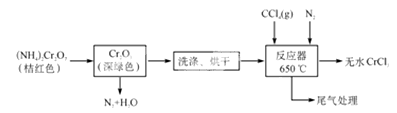
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净________________。
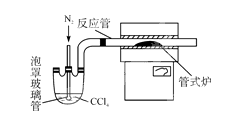
(2) 已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜的加热方式是________。
(3)用右图装置制备CrCl3时,反应管中发生的主要反应为Cr2O3+3CCl4===2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为①____________________________;
②____________________________。
(4)Cr对环境会造成严重的污染,废水中的Cr3+可用石灰乳进行沉降,写出沉降的离子方程式________________________
【知识点】化学与技术、物质制备
【答案解析】(1) 最后一次洗涤的流出液呈无色(3分)
(2) 水浴加热(并用温度计指示温度)(3分)
(3) 赶尽体系中的氧气(3分) 鼓气使反应物进入管式炉中进行反应(3分)
(4)2Cr3++3Ca(OH)2=2Cr(OH)3↓+3Ca2+(3分)
解析:(1)判断沉淀是否洗涤干净,要取最后一次洗涤液进行检验,由于本题中溶液有颜色,通过观察最后一次洗涤液的颜色即可判断沉淀是否洗涤干净。(2) 已知CCl4沸点为76.8 ℃,加热温度略高于76.8 ℃,所以适宜的加热方式是水浴加热。(3)根据三氯化铬在高温下能被氧气氧化,向三颈烧瓶中通入N2的作用为赶尽体系中的氧气,同时鼓气使反应物进入管式炉中进行反应。(4)Cr3+可用石灰乳进行沉降,可知反应物为Cr3+和3Ca(OH)2产物为Cr(OH)3沉降的离子方程式为: 2Cr3++3Ca(OH)2=2Cr(OH)3↓+3Ca2+
【思路点拨】本题主要考查物质制备中的一些问题,注意题干中的提示即可做好简答,如根据三氯化铬在高温下能被氧气氧化,向三颈烧瓶中通入N2的作用为赶尽体系中的氧气,同时鼓气使反应物进入管式炉中进行反应。


科目:高中化学 来源: 题型:
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,生产中常用催化重整等方式来实现。例如以下两个在催化重整时发生的反应:

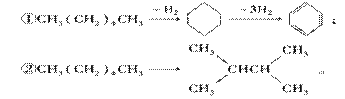
则下列叙述不正确的是 ( )
A.石油分馏后得到的汽油远不能满足需求,故常用裂化等方法生产更多的轻质油
B.使用含铅抗爆剂,会导致铅污染,故目前已禁止使用
C.①②反应过程中有机物碳原子数均没有发生变化
D.①②均为消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定条件下,一定能大量共存的是
①能使红色石蕊试纸变蓝的溶液中:K+、Na+、CO32-、NO3-
②C(H+)=10-1molL-1的溶液中:SO42-、Cu2+、Al3+
③能使碘化钾淀粉试纸变蓝的溶液中:NH4+、S2-、Br-、Na+
④水电离出的H+浓度为10-13mol/L的溶液中:Mg2+ 、Cl-、SO42-、Na+
⑤在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
⑥在含大量Fe3+的溶液中:NH4+、Na+ 、Cl-、SCN-
A.①② B.①③ C.②④ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
从化工厂铬渣中提取硫酸钠的工艺如下:
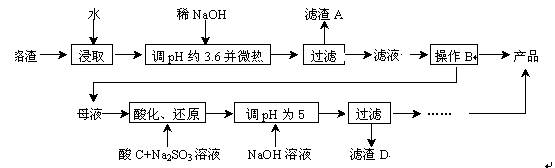
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c≤1.0×10-5 mol·L-1)时pH分别为3.6和5。

(1)“微热”除能加快反应速率外,同时还可以,滤渣A为 (填化学式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填字母序号)
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为 ;酸C为,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
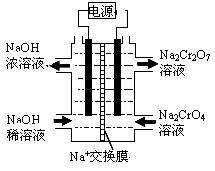
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一种白色固体可能由Na+、Ba2+、Cl-、Br-、HCO3-、SO3-、SO4-离子中的若干种组成,陶宝同学设计实验检验其组成,记录如下:
| 步骤 | 实验操作 | 实验现象 |
| ① | 将固体溶于水,用pH试纸检验 | 无色溶液pH=9 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | 产生气泡,CCl4层呈橙色 |
| ③ | 向②所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列关于固体组成的结论错误的是 ( )
A.肯定含有Br-,可能含有HCO3-
B.至少含有SO3-、SO4-中的一种离子
C.肯定不含Ba2+,一定含有Cl-
D.无需焰色反应即可断定溶液中含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是 ( )
A.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol· L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com