
【题目】以NA表示阿伏加德罗常数,下列说法正确的是( )
A. 12g石墨中含有C-C键的个数为3NA
B. 7.8gNa2O2晶体中含有阴阳离子总数为0.4NA
C. 1molSiO2晶体中含有4NA个Si-O键
D. 78g苯中含![]() 键的数目为3NA
键的数目为3NA
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池的正极的反应式_________。
(2)由 Mg、Al和氢氧化钠溶液组成的原电池中,负极的反应式 ________。当在电极上产生气体3.36L(标准状况)时,导线中通过的电子电子数目为_____个(用 NA表示阿伏加德罗常数的值)。
(3)日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池结构如下图所示,据此回答下列问题:
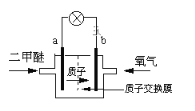
a极为电池的____极,b电极上的电极反应式为____。电池工作时电流的方向是由_______(填“a”或“b”, 下同)经导向______。电池工作时,若有0.1mol二甲醚被氧化时,有_______mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
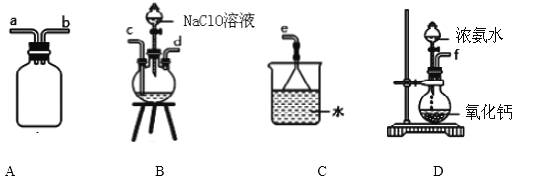
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O)
C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi+Li1-xMn2O4 ![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH ![]() M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
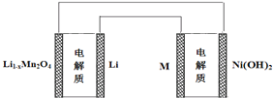
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-=Ni(OH)2+OH-
C. 下图表示用锂离子电池给镍氢电池充电
D. 锂离子电池放电时,负极的电极反应式:Li1-xMn2O4+xLi+-xe-=LiMn2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明硅酸的酸性弱于碳酸的实验事实是
A. CO2溶于水形成碳酸,SiO2难溶于水
B. CO2通入可溶性硅酸盐溶液中析出硅酸沉淀
C. 高温下SiO2与碳酸盐反应生成CO2
D. 氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com