
分析 (1)二氧化硫与溴水发生氧化还原反应生成硫酸和溴化氢;
(2)浓硫酸具有强的氧化性,与碳发生反应生成二氧化碳、二氧化硫和水;
(3)氨气具有还原性,氧气具有氧化性,氨气中氮元素为-3价,被氧气氧化为+2价的氮元素,所以氨气和氧气反应生成一氧化氮和水.
解答 解:(1)溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原反应生成硫酸和HBr,溶液中溴的颜色会褪去,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
(2)碳和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(3)NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应方程为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查了化学方程式和离子方程式的书写,题目难度中等,明确化学反应的实质是解题的关键,注意掌握化学方程式的书写原则,试题侧重考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
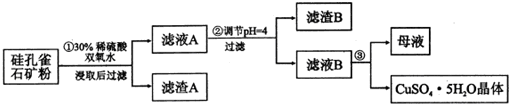
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
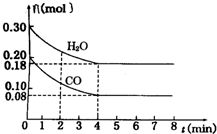 在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)
在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 和
和

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com