
【题目】将过量的0.2g铜粉与5mL1 molL1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3H2O![]() [Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________。
A. B.
B. 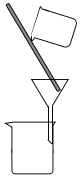 C.
C.![]() D.
D. E.
E. F.
F.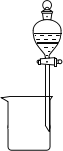
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______(填离子符号),理由是_____________________________________________。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________(列出计算式即可)。
【答案】FeCl3+Cu = FeCl2+CuCl 漏斗、玻璃棒、烧杯 Fe3+ CuCl有一定的溶解度,洗涤液中肯定会有Cl,无法判断固体表面的Cl是否洗涤干净 氨水、稀HNO3、AgNO3溶液 (![]() )mol
)mol
【解析】
根据过量的铜粉与FeCl3溶液混合时的现象,分析其中可能发生的反应。进而设计实验分离提纯混合物、探究反应产物,并进行有关计算。
(1)据题意,过量的铜粉与FeCl3溶液混合时,除主要反应2FeCl3+Cu =2FeCl2+CuCl2外,还生成CuCl。由Cu生成CuCl时铜元素化合价升高,则FeCl3变为FeCl2时铁元素化合价降低,化学方程式为FeCl3+Cu = FeCl2+CuCl。
(2)反应后溶液中有FeCl2、CuCl2和可能未反应的FeCl3,固体中有生成的CuCl和多余的Cu,使用过滤装置(B)进行分离,其中的仪器有漏斗、玻璃棒、烧杯。
(3)溶液中生成的沉淀表面吸附在可溶性杂质,故过滤后需洗涤沉淀;CuCl不溶于水,但溶解度不为零,洗涤液中肯定会有Cl,无法判断固体表面的Cl是否洗涤干净,故检验洗涤液中是否含有Fe3+。
(4)取少量经过洗涤的固体,先加氨水振荡并过滤,向滤液中滴加硝酸银溶液和稀硝酸,有白色溶液生成,则灰白色固体中含有CuCl。实验过程中用到的试剂氨水、AgNO3、稀HNO3。
(5)a g灰白色固体中,有 b gCuCl,则有(a-b) gCu。据题意有![]() +(a-b) g+
+(a-b) g+![]() =0.2g,解得n(CuCl2)=(
=0.2g,解得n(CuCl2)=(![]() )mol。
)mol。


科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疔等领域都有着重要的应用。请回答下列问题:
(1)基态Ti原子的价电子轨道表示式为___________。
(2)化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是___________ (填元素符号),该原子的杂化类型为___________杂化,该晶体所含元素中,电负性最大的元素是___________ (填元素符号)。
(3)化学式为[Ti(H2O)5 Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol该晶体溶于水配成500mL溶液,加入足量AgNO3溶液使Cl-完全沉淀,消耗AgNO3的物质的量为___________mol。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是______________________。
(5)TiO2能溶浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图所示,阳离子化学式为___________,写出一种与SO42-互为等电子体的分子___________。

(6)下图是钛晶体在空间的一种堆积方式,此堆积方式名称为___________,钛原子的配位数为__________。已知:a=0.295nm,c=0.469nm,则该钛晶体的密度为___________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。

①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界__________。
(2)表中最活泼的金属与最活泼的非金属形成的物质是__________________(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_________________________________________________________________________________,这两种化合物中所含的化学键有________(填字母)。
A 极性共价键 B 非极性共价键 C 离子键
(4)e、f、k、m对应的单原子离子的半径由大到小的顺序为__________(填离子符号)。
(5)d、m对应的离子还原性由强到弱顺序为___________________________________(填离子符号)。
(6)d、e、m的气态氢化物中,最不稳定的是________________________(填分子式)。
(7)用电子式表示n与m形成的原子个数比2∶1的化合物的形成过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是 ( )
A.苯酚呈弱酸性,能使石蕊试液显浅红色
B.苯酚分子中的13个原子一定处于同一平面上
C.苯酚有强腐蚀性,沾在皮肤上可用酒精洗涤
D.苯酚能与FeCl3溶液反应生成紫色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1L1.0mol/L的NaOH溶液吸收0.8molSO2,所得溶液中的SO32-和HSO3-的物质的量之比为( )
A.1:3B.1:2C.2:3D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查尔酮是一种能制备抗炎药物的化工原料。其中一种合成路线如下:

(1)B的名称为_________;查尔酮含有的含氧官能团名称是_________。
(2)A→B的反应类型是_________;C的结构简式为_________。
(3)写出E→F的化学方程式_________。
(4)F的同分异构体中,含有![]() 结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。
结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。
(5)已知: 。参照上述流程,以CH2=CH-CH3为原料合成
。参照上述流程,以CH2=CH-CH3为原料合成  ,设计最简合成路线。_______________
,设计最简合成路线。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com