
| A. | 高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA | |
| B. | 46 g Na与0.5 L 2 mol•L-1盐酸充分反应,转移电子数为2NA | |
| C. | 8.4 g固体NaHCO3中,含有阳离子0.2NA | |
| D. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA |
分析 A、合成氨的反应为可逆反应;
B、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
C、求出碳酸氢钠的物质的量,然后根据碳酸氢钠由钠离子和碳酸氢根构成来分析;
D、标况下四氯化碳为液体.
解答 解:A、合成氨的反应为可逆反应,故不能进行彻底,则断裂的H-H键小于3NA条,故A错误;
B、46g钠的物质的量为2mol,和盐酸溶液反应时,先和盐酸反应,若盐酸不足则再和水反应,故金属钠能反应完,而钠反应后变为+1价,故2mol钠转移2NA个电子,故B正确;
C、8.4g碳酸氢钠的物质的量为0.1mol,而碳酸氢钠由钠离子和碳酸氢根构成,故0.1mol碳酸氢钠中含0.1NA个阳离子,故C错误;
D、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
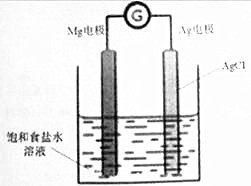 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )| A. | 镁电极上发生还原反应 | |
| B. | 银电极的电极反应式:AgCl+e-=Ag+Cl- | |
| C. | 该装置中能最转化方式为电能转化为化学能 | |
| D. | 电池工作时,钠离子移向镁电极,氯离子移向银电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡体系中各组分的浓度发生改变 | B. | 平衡体系中气体密度发生改变 | ||
| C. | 正、逆反应速率不相等了 | D. | 平衡体系中气体压强发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2O的体积约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 20℃、101 kPa时1mol HCl所占的体积约为22.4 L | |
| D. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉可用于养殖业消毒杀菌 | B. | SiO2可用于制光导纤维 | ||
| C. | FeCl3溶液可用于蚀刻铜制线路板 | D. | AlCl3可用于电解冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com