
����Ŀ����ҵ���������Ҫ��ӦΪ4NH3(g)+5O2(g)4NO(g)+6H2O(l)��H
(1)��֪��������ȼ����Ϊ285.8kJmol-1
N2(g)+3H2(g)2NH3(g)��H=-92.4kJmol-1
N2(g)+O2(g)2NO(g)��H=+180.6kJmol-1
��������ҵ���������Ҫ��Ӧ����H=______��
(2)���ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
Ũ�� | c(NH3)(molL-1) | c(O2)(molL-1) | c(NO)(molL-1) |
��ʼ | 0.8 | 1.6 | 0 |
��2min | 0.6 | a | 0.2 |
��4min | 0.3 | 0.975 | 0.5 |
��6min | 0.3 | 0.975 | 0.5 |
��8min | 0.7 | 1.475 | 0.1 |
�ٷ�Ӧ�ڵ�2min����4min�ڣ�O2��ƽ����Ӧ����Ϊ______��
�ڷ�Ӧ�ڵ�6minʱ�ı����������ı������������______(�����)��
A ʹ�ô���������B �����¶�C ��СѹǿD ����O2��Ũ��
������˵������˵��4NH3(g)+5O2(g)4NO(g)+6H2O(g)�ﵽƽ��״̬����_____(�����)��
A ��λʱ��������nmolNO��ͬʱ������nmolNH3
B ����һ������������ƽ����Է����������ٱ仯
C �ٷֺ���w(NH3)=w(NO)
D ��Ӧ����v(NH3)��v(O2) ��v(NO) ��v(H2O)=4��5��4��6
E ���ں��º�ѹ���ݻ��ɱ�������з�Ӧ�����������ܶȲ��ٱ仯
(3)ij�о�����װ��CH3OH-O2ȼ�ϵ�صĹ���ԭ����ͼ��ʾ��
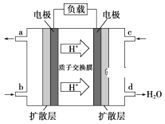
�ٸõ�ع���ʱ��b��ͨ�������Ϊ______��
�ڸõ�������ĵ缫��ӦʽΪ______��
���𰸡�-1168.8kJ/mol 0.1875mol/��Lmin�� B ABE CH3OH O2+4e-+4H+=2H2O
��������
(1)������ȼ����Ϊ285.8kJ/mol��д���Ȼ�ѧ��Ӧ����ʽ��������еķ���ʽ�����ݸ�˹���ɷ������
(2)�ٸ��ݰ�����Ũ�ȱ仯������������ʣ��������������ʣ�
���ȷ���ͼ���з�Ӧ����������Ũ�ȵı仯���ٸ������Ի�ѧƽ���Ӱ�������
�۸��ݴﵽƽ��״̬�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯�������жϣ�
(3)����ͼʾ�������ӵ��ƶ���������жϸ�ȼ�ϵ�ص������������ԭ���ԭ���������
(1)��֪������ȼ����Ϊ285.8kJ/mol�����O2(g)+2H2(g)�T2H2O(l)��H=-571.6kJ/mol����N2(g)+3H2(g)�T2NH3(g)��H=-92.4kJ/mol����N2(g)+O2(g)�T2NO(g)��H=+180.6kJ/mol���ɸ�˹���ɣ�3����-2����+2���۵ã�4NH3(g)+5O2(g)4NO(g)+6H2O(l) ��H=(-571.6kJ/mol)��3-(-92.4kJ/mol)��2 +(+180.6kJ/mol)��2 =-1168.8kJ/mol���ʴ�Ϊ��-1168.8kJ/mol��
(2)�ٷ�Ӧ�ķ���ʽΪ4NH3(g)+5O2(g)4NO(g)+6H2O(l)��H=-1168.8kJ/mol��������ƽ����ѧ��Ӧ����Ϊv=![]() =
=![]() =0.15 mol/(Lmin)��ͬһ��ѧ��Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����������ƽ����ѧ��Ӧ����Ϊ��0.15 mol/(Lmin)��
=0.15 mol/(Lmin)��ͬһ��ѧ��Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����������ƽ����ѧ��Ӧ����Ϊ��0.15 mol/(Lmin)��![]() =0.1875 mol/(Lmin)���ʴ�Ϊ��0.1875mol/(Lmin)��
=0.1875 mol/(Lmin)���ʴ�Ϊ��0.1875mol/(Lmin)��
��ͨ��ͼ���Ƚϵ�6min�͵�8min��Ӧ����������Ũ��֪����Ӧ��Ũ������������Ũ�ȼ�С��ƽ�����ƣ����Ըı�������������¶ȣ���B��ȷ���ʴ�Ϊ��B��
��A����λʱ��������n mol NOΪ�����ʣ�����n molNH3Ϊ�����ʣ�������������֮�ȵ��ڻ�ѧ������֮�ȣ���ʾ���淴Ӧ������ȣ���˵����Ӧ�ﵽ��ƽ��״̬����A��ȷ��B���÷�Ӧ������������ʵ�������ķ�Ӧ��������������䣬������ƽ����Է���������С��������������ƽ��Ħ���������䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����B��ȷ��C���ٷֺ���w(NH3)=w(NO)������˵����Ӧ����������Ũ�Ȳ��ٱ仯���������ж��Ƿ�ﵽƽ��״̬����C����D����Ӧ����v(NH3)��v(O2) ��v(NO) ��v(H2O)=4��5��4��6����Ӧ��ʼ��ʼ�ճ���������˵����Ӧ�ﵽƽ��״̬����D����E���÷�Ӧ���������ķ�Ӧ����Ӧ������������������䣬����������ܶ���С�����ܶȲ����ˣ�˵����Ӧ�ﵽ��ƽ��״̬����E��ȷ���ʴ�Ϊ��ABE��
(3)�ٸ���ͼʾ����������a��缫����c��缫����c��缫Ϊ����������c��ͨ�������������b��ͨ�������ΪCH3OH���ʴ�Ϊ��CH3OH��
��c��缫Ϊ������ͨ����������������ĵ缫��ӦΪ��O2+4e-+4H+=2H2O���ʴ�Ϊ��O2+4e-+4H+=2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����ͼʾװ�òⶨ��þ�Ͻ������������������������ԭ��������
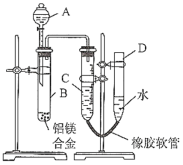
(1)A���Լ�Ϊ__________________
(2)ʵ��ǰ���Ƚ���þ�Ͻ���ϡ���н���Ƭ�̣���Ŀ����_______________________________
(3)��������ԣ���ҩƷ��ˮװ��������У����Ӻ�װ�ú�����еIJ������У��ټ�¼C��Һ��λ�ã��ڽ�B��ʣ�������ˣ�ϴ�ӣ�������أ��۴�B�в���������������ָ������º�¼C��Һ��λ�ã�����A��B�μ������Լ�������������˳����_______________________������ţ���
(4)B�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________________________________________
(5)��ʵ������þ�Ͻ������Ϊag������������ΪbmL(�ѻ���Ϊ��״��)��B��ʣ����������Ϊcg�����������ԭ������Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ������·�����ȡCl2�����������Ϣ���ش��������⣺
(1)�ڸ÷�Ӧ�У�HCl���ֵ�������______��________.
��MnO2 +4HCl��Ũ��![]() Cl2��+ MnCl2+ 2H2O
Cl2��+ MnCl2+ 2H2O
(2)����Ӧ����0.1mol������������ԭ��������������Ϊ________���ѧʽ�������������ʵ����ʵ���Ϊ _____��ͬʱת�Ƶ�����Ϊ_____(��NA��ʾ)��
(3)��(2)���ɵ������� 0.2mol H2 ��ȫ��Ӧ�����ɵ������ڱ�״������ռ���Ϊ_________�����˲�������ˮ���100mL��Һ������Һ�����ʵ���Ũ��Ϊ_______��
(4)��KClO3��6HCl(Ũ)=3Cl2����KCl��3H2O��2KMnO4��16HCl(Ũ)=2KCl��2MnCl2��5Cl2����8H2O
��Ҫ�Ƶ���ͬ�������������٢ڢ�������Ӧ�е���ת�Ƶ���Ŀ֮��Ϊ____��
(5)��֪��Ӧ4HCl(g)��O2  2Cl2��2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ_______��
2Cl2��2H2O(g)���÷�ӦҲ���Ƶ���������MnO2��O2��KMnO4����������������ǿ������˳��Ϊ_______��
(6)��������NaOH��Ʒ2.50 g(��Ʒ������Na2CO3��ˮ)������50.0 mL 2.00mol/L�����У���ַ�Ӧ����Һ�����ԣ��кͶ����������ȥ40.0 mL 1.00 mol/L��NaOH��Һ�������кͺ����Һ�����յõ����������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȱ���ȩ������ũҩ��ҽҩ���л��ϳɵ��м��壬����Ҫ���л�������Ʒ��ʵ������ȡ���ȱ���ȩ�Ĺ������¡�
��Cl2���Ʊ�
���շ��������ķ�����������ʵ�����Ʊ���������ʵ�������ø÷����Ʊ�Cl2��
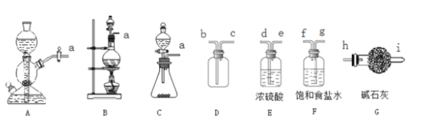
��1���÷�������ѡ��ͼ�е�_____������ĸ��ţ�ΪCl2����װ�ã���Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ_______��
��2��ѡ��ͼ�е�װ���ռ�һƿ���������Cl2���ӿڵ�����˳��Ϊa��___________��������������Сд��ĸ��ţ�
��3������ƽ���ƶ�ԭ�������ñ���ʳ��ˮ��ȥCl2�л��е�HCl��ԭ��_____________________��
���ȱ���ȩ���Ʊ�
��Ӧԭ����
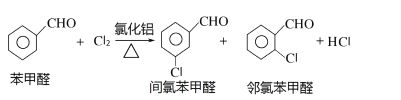
ʵ��װ�ú�������ͼ��ʾ��
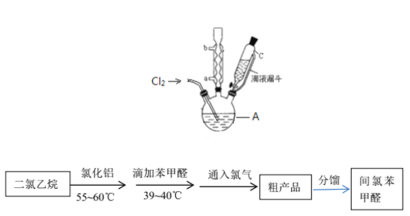
��4��ͼ������A��������_____________��
��5�����ȱ���ȩ���Ʊ������У����������������________________________����ʵ��Ҫ����ˮ������������____________________________________________����ʵ�������κ��¹��̣�Ϊ���Ʒ�Ӧ�¶�����A���ɲ���________���ȵķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H=��49.0kJ��mol��1��һ�������£������Ϊ1L���ܱ������г���lmolCO2��3mo1H2�����CO2��CH3OH��g����Ũ����ʱ��仯������ͼ��ʾ��������������ȷ����
CH3OH��g��+H2O��g�� ��H=��49.0kJ��mol��1��һ�������£������Ϊ1L���ܱ������г���lmolCO2��3mo1H2�����CO2��CH3OH��g����Ũ����ʱ��仯������ͼ��ʾ��������������ȷ����

A. �����¶�ƽ�ⳣ��K����
B. ��Ӧ�ﵽƽ��״̬ʱ��CO2��ƽ��ת����Ϊ75%
C. 3minʱ����CO2��Ũ�ȱ�ʾ������Ӧ���ʵ�����CH3OH��Ũ�ȱ�ʾ���淴Ӧ����
D. �ӷ�Ӧ��ʼ��ƽ�⣬H2��ƽ����Ӧ����v��H2��=0.075 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������ȼ�ϵ����ͼ��ʾ�����й��ڸõ��˵����ȷ����

A��a�缫������ԭ��Ӧ����ԭ��ص�����
B��b�缫��ӦʽΪ��2NO3����10e����12H+��N2����6H2O
C��H+������ͨ�����ӽ���Ĥ��������
D����״���£���·�в���6moLCO2ͬʱ����22.4L��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1��Ԫ��K����ɫ��Ӧ���Ϻ�ɫ��������ɫ��Ӧ�ķ��䲨��Ϊ_______nm�����ţ���
A��404.4 B��553.5 C��589.2 D��670.8 E.766.5
��2����̬Kԭ���У��������ռ�ݵ�����ܲ�ķ�����_________��ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ___________��K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ��������K���۵㡢�е�ȶ��Ƚ���Cr�ͣ�ԭ����___________________________��
��3��X��������ⶨ�ȷ��֣�I3AsF6�д���I3+���ӡ�I3+���ӵļ��ι���Ϊ_____________������ԭ�ӵ��ӻ���ʽΪ________________��
��4��KIO3������һ���������õķ����Թ�ѧ���ϣ����и��ѿ��͵�����ṹ���߳�Ϊa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã���ͼ��ʾ��K��O�����̾���Ϊ______nm����K���ڵ�O����Ϊ__________��
��5����KIO3�����ṹ����һ�ֱ�ʾ�У�I���ڸ�����λ�ã���K����______λ�ã�O����______λ�á�
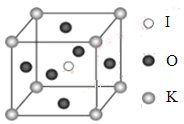
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ�������,�������·�Ӧ:2A(g)+ B(g) ![]() 2C(g)+D(g) ������������A��B����4 mol����ǰ10����A��ƽ����Ӧ�ٶ�Ϊ0.12 mol/��L������10����ʱ��������B�����ʵ������� ��
2C(g)+D(g) ������������A��B����4 mol����ǰ10����A��ƽ����Ӧ�ٶ�Ϊ0.12 mol/��L������10����ʱ��������B�����ʵ������� ��
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ��Ҫ������ѧר�������������������йػ�ѧ������ȷ����(����)
A.N2����ʽΪ![]()
B.Cl���Ľṹʾ��ͼΪ![]()
C.CO2�ĽṹʽΪO��C��O
D.�Ȼ�þ�ĵ���ʽ��Mg2��[C![]() ]
]![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com