
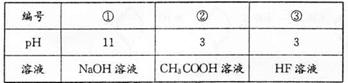
已知HF酸性强于CH3COOH,常温下有下列三种溶液.有关叙述不正确的是( )
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
 MnS2O6的△H
MnS2O6的△H查看答案和解析>>
科目:高中化学 来源:2011届江苏省淮阴中学高三上学期期末模拟化学试卷 题型:填空题
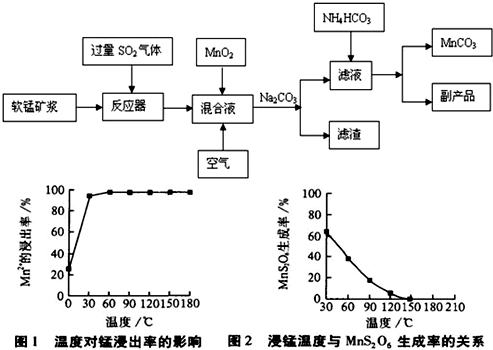
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下: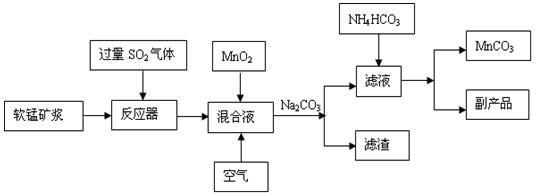
已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
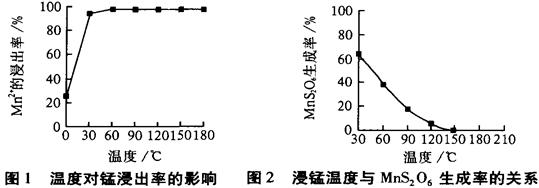
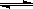 MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
已知HF酸性强于CH3COOH,常温下有下列三种溶液。有关叙述不正确的是
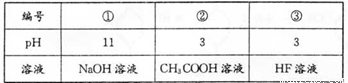
A.②、③混合后:C(H+)=C(F-)+C(CH3COO-)+ c(OH-)
B.①、②等体积混合后:c(CH3COO-)>c(Na+)>C(H+)>c(OH-)
C.中和相同体积的②、③,需消耗相同体积的①
D.向②加入NaF固体,CH3C00H电离平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com