
| A. | X的化学式为Ag2S | B. | 银针验毒时,空气中氧气得到电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | 每生成1mo1X,反应转移2mo1 e- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

 +2Ag[(NH3)2]OH
+2Ag[(NH3)2]OH
 +2Ag+3NH3+H2O
+2Ag+3NH3+H2O ,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为
,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它是氧化物 | B. | 它含有3种元素 | ||
| C. | 它的摩尔质量是44g | D. | 1 mol环氧乙烷含有2NA个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
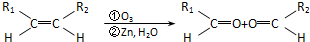
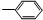 ③-CH═CH2
③-CH═CH2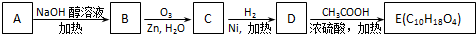
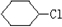 、
、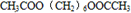 .
.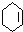
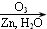
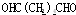 ;
;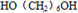 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$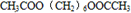 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.33 kJ•mol-1,则CH4的燃烧热为802.33 kJ | |
| C. | 稀硫酸与0.1 mol•L-1NaOH溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com