
【题目】下列关于甲、乙、丙、丁四种有机物的说法正确的是
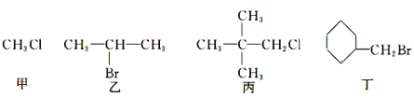
A.甲中加入AgNO3溶液,有沉淀生成
B.乙发生消去反应得到两种烯烃
C.丙中加入NaOH醇溶液共热,后加入稀硝酸至酸性,再滴入AgNO3溶液,有沉淀生成
D.丁加入NaOH溶液共热,然后加入稀硝酸调至酸性,再滴入AgNO3溶液,有沉淀生成
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在![]() 之间,通过电解生成
之间,通过电解生成![]() 沉淀.
沉淀.![]() 有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去
有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去![]() 或撇掉
或撇掉![]() 浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:

![]() 电解池阳极的电极反应分别是:
电解池阳极的电极反应分别是:![]() ______ ;
______ ;![]()
![]() 熔融盐燃料电池是以熔融碳酸盐为电解质,以
熔融盐燃料电池是以熔融碳酸盐为电解质,以![]() 为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:
为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是:![]()
![]() 正极的电极反应是 ______ .
正极的电极反应是 ______ .
![]() 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是 ______ .
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环.则A物质的化学式是 ______ .
![]() 实验过程中,若在阴极产生了
实验过程中,若在阴极产生了![]() 标准状况
标准状况![]() 气体,则熔融盐燃料电池消耗
气体,则熔融盐燃料电池消耗![]() 标准状况
标准状况![]() ______ L.
______ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 得到澄清溶液 |
|
B | 将 | 溶液变红 | 稀硫酸能氧化 |
C | 室温下,用pH试纸分别测定浓度为 | pH试纸都变成碱色 | 可以用pH试纸的颜色与标准比色卡比较,从而判断HClO和 |
D | 向少量 | 开始有白色沉淀生成,后有黑色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物说法正确的是

A.两种酸与溴水反应现象相同
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子比莽草酸分子多两个碳碳双键
D.等物质的量的两种酸消耗NaOH物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废铝屑(含Al、Al2O3、Fe及Fe的氧化物)制取纯净的无水氯化铝,主要过程如下:
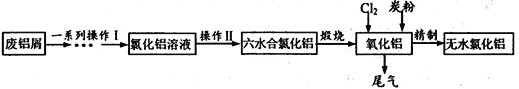
(1)检验氯化铝溶液中是否含有微量的Fe3+,可用的试剂为__________。
(2)操作II的步骤为__________、结晶、过滤、洗涤。
(3)煅烧过程的化学反应方程式为____________________。
(4)在强热条件下,Al2O3转化为AlCl3的反应如下:
Al2O3(s)+3Cl2(g)+3C(s)=2AlCl3(g)+3CO(g) △H>0
Al2O3(s)+3Cl2(g)+ ![]() C(s)=2AlCl3(g)+
C(s)=2AlCl3(g)+ ![]() CO2 (g) △H<0
CO2 (g) △H<0
工业上在通氯气的同时鼓入适量的氧气,其目的是:
①除去多余的碳粉;②_________。
(5)利用下列试剂设计由废铝制备氧化铝溶液的“一系列操作I”的实验方案:________。
实验中可供选择的试剂:6mol·L-1HCl溶液、3 mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、氨水、H2O、CO2。
(6)AlCl3的熔点为190℃,沸点为183℃。1973年美国Alcoa公司研究出一种新的氯化铝电解制铝法。将AlCl3和NaCl、KCl、LiCl混溶电解冶炼铝,其中NaCl、KCl、LiC的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲增加Mg(OH)2在水中的溶解,可采用的方法是 ( )
A.增加溶液pHB.加入2.0mol/L NH4Cl
C.加入0.1mol/L MgSO4D.加入适量95%乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
2C(g)+2D(g),反应进行到10 s末,测得A的物质的量为1.8 mol, B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
(1)用C表示10 s内反应的平均反应速率为__________;
(2)反应前A的物质的量浓度是__________;
(3)10 s末,生成物D的浓度为________;
(4)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | _______ |
② | 增大A的浓度 | _______ |
③ | 使用催化剂 | _______ |
④ | 恒容下充入Ne(不参与体系反应) | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,咖啡酸苯乙酯是蜂胶的主要活性成分,可由咖啡酸合成,合成方法如图。

下列说法不正确的是( )
A.咖啡酸分子中所有碳原子可能处在同一个平面上
B.1mol咖啡酸苯乙酯与足量的溴水反应,最多消耗3molBr2
C.1mol苯乙醇在O2中完全燃烧,需消耗10molO2
D.1mol咖啡酸苯乙酯与足量的NaOH溶液反应,最多消耗3molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com