
| A、铁与盐酸的反应:2Fe+6H+=2Fe3++3H2↑ |
| B、石灰石与稀盐酸反应制备二氧化碳:CO32-+2H+=H2O+CO2↑ |
| C、向氢氧化铜中滴加硫酸溶液:H++OH-=H2O |
| D、硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、① | B、④ | C、②③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | ××× |
| 配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
| 保质期 | 240天 |
| 生产日期 | 标于包装袋袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°C时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,1molCF4中含有的电子对数目为4.0NA |
| C、1L 0.5mol?L-1 的H2SO3溶液中含有的H+数目为NA |
| D、一定条件下1molN2与3molH2混合充分反应后生成NH3分子数小于2.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的N2和CO所含分子数均为NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.2NA |
| C、2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
| D、常温常压下48gO2和48gO3含有的氧原子数均为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子或物质 | 条件 | |
| A | SO2、O2、NO2 | 通入足量NaOH溶液后,可能没有任何气体剩余 |
| B | Fe3+、SO32-、Cl- | 加入NaOH溶液,产生红褐色沉淀 |
| C | Ba2+、HCO3-、Cl-、H+ | 加入氨水立即产生沉淀 |
| D | Na+、K+、Cl-、SO42- | c(Na+)+c(K+)=c(SO42-)+c(Cl-) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氢元素的化合物中一定有氢键 |
B、因为分子间存在氢键的缘故, 比 比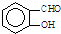 熔沸点高 熔沸点高 |
| C、由于氢键比范德华力强,所以H2O分子比H2S分子稳定 |
| D、“可燃冰”--甲烷水合物(例如:8CH4?46H2O)中CH4与H2O之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,精铜作阴极 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com