
下列各组物质与其用途的关系不正确的是
A.过氧化钠——供氧剂 B.金属镁——制照明弹
C.苏打——发酵粉主要成分 D.明矾——净水剂
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2016届浙江省高一上学期期中考试化学试卷(解析版) 题型:计算题
今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| 氢氧化钠质量(g) | 氯化钠质量(g) |
① | 2.40 | 3.51 |
② | 2.32 | 2.34 |
③ | 3.48 | 3.51 |
上述实验①②③数据可靠。通过计算,分析和比较上表3组数据,给出结论。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高一上学期期中考试化学试卷(解析版) 题型:选择题
根据下列反应:①Cu + 2FeCl3 = 2FeCl2 + CuCl2 ②2FeCl2 + Cl2 = 2FeCl3
③MnO2 + 4HCl(浓) MnCl2 + Cl2?+2H2O 判断以下各组物质的氧化性由强到弱顺序正确的是
MnCl2 + Cl2?+2H2O 判断以下各组物质的氧化性由强到弱顺序正确的是
A.MnO2、FeCl3、Cl2、CuCl2 B.Cl2、FeCl3、MnO2、CuCl2
C.MnO2、Cl2、FeCl3、CuCl2 D.CuCl2、FeCl3、Cl2、MnO2
查看答案和解析>>
科目:高中化学 来源:2016届浙江省湖州市高一上学期期末考试化学试卷(解析版) 题型:选择题
向Fe和Fe2O3的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为5︰2时,则Fe和Fe2O3的物质的量之比为
A.3︰1 B.1︰2 C.2︰1 D.1∶1
查看答案和解析>>
科目:高中化学 来源:2016届浙江省湖州市高一上学期期末考试化学试卷(解析版) 题型:选择题
在强酸性溶液中可以大量共存的离子组是
A.K+、NO3ˉ、OHˉ、Clˉ B.SO42-、Mg2+、Clˉ、Na+
C.SO42-、Na+、Mg2+、CH3COOˉ D.Clˉ、SCNˉ、K+、Fe3+
查看答案和解析>>
科目:高中化学 来源:2016届浙江省湖州市属九校高一12月联考化学试卷(解析版) 题型:填空题
下图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹。(氯气在饱和氯化钠溶液中的溶解度较小。)
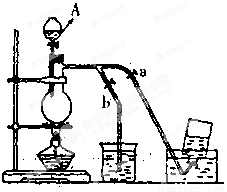
(1)仪器A的名称是 ;水槽中应盛放的是 ;烧杯中盛放的是 ;烧瓶中反应的化学方程式 ;
在收集氯气时,应打开 关闭 (填a, b)当氯气收集完毕,尾气处理时烧杯中发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省湖州市属九校高一12月联考化学试卷(解析版) 题型:选择题
在100mL含等物质的量的HI和H2SO3的溶液里通入0.14molCl2,有三分之一的HI变为I2(已知:I2+H2SO3+H2O=4H++SO42—+2I—)。原溶液中HI和H2SO3的浓度都等于
A.8.0 mol?L-1 B.0.12 mol?L-1
C.0. 8 mol?L-1 D.1.2 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市高一上学期期末模拟考试化学试卷(解析版) 题型:填空题
1886年,德国夫赖堡(Frieberg)矿业学院的一位教授在分析夫赖堡附近发现的一种新矿石(以X表示,X为整比化合物)的时候,发现其中有一种当时未知的新元素(以Y表示,在X中Y的化合价为+4),并通过实验验证了自己的推断。经分析,X中含有银元素(化合价为+1)和硫元素(化合价为-2),其中Ag的质量分数为76.53%。在氢气流中加热X,可得到Ag2S、H2S和Y的低价硫化物(Y的化合价为+2)。如果在200℃和100kPa条件下完全转化16.0g的X需要0.557L的氢气。根据上面的描述:
(1)计算Y的摩尔质量并指出Y在元素周期表中的位置
(2)写出X的化学式
(3)写出氢气和X反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如
将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快
B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快
C.“纳米铜”与铜是同素异形体
D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com