
【题目】物质的量浓度相同的下列溶液中:①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4 c(NH4+)由大到小的顺序是( )
A.②③①④
B.④①③②
C.③②①④
D.③②④①
【答案】D
【解析】解:物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2CO3、③(NH4)2SO4、④NH4HSO4;先不考虑水解,则②(NH4)2CO3 和 ③(NH4)2SO4 都含有两个NH4+ , 所以它们NH ![]() 的浓度大于其它三种物质,而②(NH4)2CO3 中NH
的浓度大于其它三种物质,而②(NH4)2CO3 中NH ![]() 水解显酸性,CO
水解显酸性,CO ![]() 水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,③(NH4)2SO4中硫酸根离子对铵根离子浓度无影响,即溶液中c(NH4+)③>②; ①④二种物质中,④NH4HSO4酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH
水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,③(NH4)2SO4中硫酸根离子对铵根离子浓度无影响,即溶液中c(NH4+)③>②; ①④二种物质中,④NH4HSO4酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH ![]() )较大,
)较大,
①NH4Cl,NH4+水解,④NH4HSO4 , 溶液中氢离子抑制铵根离子水解,即溶液中c(NH ![]() )④>①;
)④>①;
按c(NH ![]() )由大到小的顺序排列为:③>②>④>①,
)由大到小的顺序排列为:③>②>④>①,
故选:D.
①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4 先不考虑水解,则②(NH4)2CO3和③(NH4)2SO4都含有两个NH4+ , 所以它们NH4+的浓度大于其它三种物质,溶液中c(NH ![]() )根据盐类水解的影响分析判断.
)根据盐类水解的影响分析判断.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示: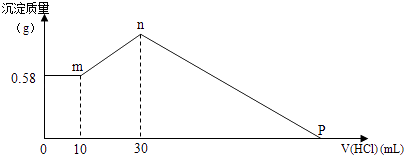
(1)混合物中NaOH的质量是g,AlCl3的质量是g.
(2)P点所表示盐酸加入体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃科电池具有体积小,无需气体存储装置等优点。一种以胼(N2H4)为燃料的电池装置如下图装置①,该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是
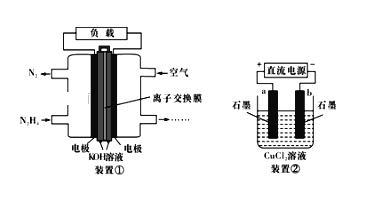
A. 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O
B. 用该燃料电池作为装置②的直流电源,产生7.1gCl2至少需加入0.5molN2H4
C. 该燃料电池放电一段时间后,KOH溶液的pH保持不变(KOH溶液经充分搅拌且忽略反应过程中溶液体积的改变)
D. 该燃料电池的电极材料应采用多孔导电材料,其目的是提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
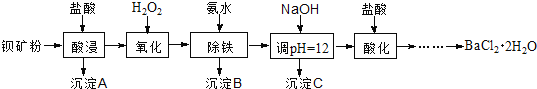
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )

A. Y的最高价氧化物对应水化物的酸性比X的弱
B. 原子半径Z<M
C. X的最简单气态氢化物的热稳定性比Z的小
D. Z位于元素周期表中第2周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存且溶液颜色为无色的是( )
A.Na+、MnO4﹣、K+、NO3﹣SO32﹣
B.Na+、S2﹣、SO32﹣、H+、NO3﹣
C.Na+、S2﹣、OH﹣、K+、Cl﹣
D.HCO3﹣、H+、Na+、Ca2+SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 ____。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 ____。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ____,微粒间存在的作用力是 ____。
(3)氧化物MO的电子总数与SiC的相等,则M为 ____(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 ____。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2 的分子构型是 ________, SiO2的沸点 _______CO2的沸点(填“高于”或“低于”) ,理由是 _____________________。 CO2分子中σ键和π键的个数比为 ___________,其中心原子采取 _______杂化;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.在蔗糖水解后的溶液中,先加入稍过量的碱再滴加银氨溶液,验证产物中的葡萄糖
B.淀粉中加入20%的H2SO4溶液在酒精灯上加热,使其水解
C.向蔗糖中加入浓硫酸后加热,一段时间后得到葡萄糖和果糖
D.向淀粉水解后的溶液中先加氢氧化钠中和催化剂硫酸,再加入碘水,观察溶液是否变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com