
【题目】将锌铜合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:
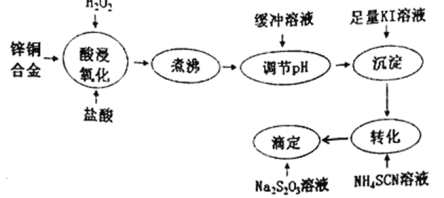
回答下列问题:
(1)H2O2的电子式为___________;“酸浸氧化”后铜元素的主要存在形式是___________(填离子符号)。
(2)“煮沸”的目的是____________________________________________。
(3)用缓冲溶液“调pH”是为了避免溶液的酸性太强,否则“滴定”时发生反应的离子方程式:_______________________________________________________;
①若100mLNa2S2O3溶液发生上述反应时,20s后生成的SO2比S多6.4g,则v(Na2S2O3)=___________mol/(L·s)(忽略溶液体积变化的影响)。
②该缓冲溶液是浓度均为0.10mol/L的CH3COOH和 CH3 COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________________________________。(已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5)
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为______________________。
(5)“转化”步骤中,CuI转化为 CuSCN, CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN-):c(I-)≥___________。(已知:Ksp(CuI)=1.0×10-12;Ksp( CuSCN)=4.4×10-15)
(6)下列情况可能造成测得的铜含量偏高的是___________(填标号)。
A.铜锌合金中含少量铁
B.“沉淀”时,I2与I-结合生成I3-:I2+ I-= I3-
C.“转化后的溶液在空气中放置太久,没有及时滴定
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水
【答案】![]() Cu2+ 除去过量的H2O2 S2O32-+2H+=S↓+SO2↑+H2O 0.1 c(CH3COO-)>c(NH4+)>c(H+)>c(OH-) 2Cu2++4I-=2CuI+I2 4.4×10-3 AC
Cu2+ 除去过量的H2O2 S2O32-+2H+=S↓+SO2↑+H2O 0.1 c(CH3COO-)>c(NH4+)>c(H+)>c(OH-) 2Cu2++4I-=2CuI+I2 4.4×10-3 AC
【解析】
(1)H2O2是共价化合物,其电子式为![]() ;铜在酸性条件下被氧化为Cu2+;
;铜在酸性条件下被氧化为Cu2+;
(2)H2O2不稳定,加热后能除去;
(3)酸性太强,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O;
①由反应S2O32-+2H+=S↓+SO2↑+H2O可知,每生成1molSO2和1molS,生成的SO2比S多32g,据此计算参加反应的硫代硫酸钠的物质的量,再根据![]() =
=![]() 计算速率;
计算速率;
②根据25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5可知,CH3COONH4溶液呈中性,故等浓度的CH3COOH和 CH3COONH4的混合溶液呈酸性,据此分析离子浓度大小;
(4)Cu2+与I-生成CuI,据此写出反应的离子方程式;
(5)根据c(SCN-):c(I-)≥![]() 计算。
计算。
(6)根据反应式2Cu2++4I-=2CuI+I2,凡能造成I2偏大的,所测铜含量偏高分析。
(1)H2O2是共价化合物,其电子式为![]() ;铜在酸性条件下被H2O2氧化为Cu2+,所以溶解后铜元素以Cu2+形式存在;
;铜在酸性条件下被H2O2氧化为Cu2+,所以溶解后铜元素以Cu2+形式存在;
因此,本题正确答案为:![]() ;Cu2+;
;Cu2+;
(2)H2O2不稳定,加热后能除去,所以“煮沸”的目的是除去过量的H2O2;
因此,本题正确答案为:除去过量的H2O2;
(3)酸性太强,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O;
①由反应S2O32-+2H+=S↓+SO2↑+H2O可知,每生成1molSO2和1molS,生成的SO2比S多32g,20s后生成的SO2比S多6.4g,则20s后生成0.2molSO2,参加反应的硫代硫酸钠为0.2mol,故![]() (Na2S2O3)=
(Na2S2O3)=![]() =0.1mol/(L·s);
=0.1mol/(L·s);
②根据25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5可知,CH3COONH4溶液呈中性,故等浓度的CH3COOH CH3COONH4的混合溶液呈酸性,则溶液中各种离子浓度由大到小的顺序为c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)。
因此,本题正确答案为:S2O32-+2H+=S↓+SO2↑+H2O;0.1;c(CH3COO-)>c(NH4+)>c(H+)>c(OH-);
(4)Cu2+与I-生成CuI,反应的离子方程式为2Cu2++4I-=2CuI+I2;
因此,本题正确答案为:2Cu2++4I-=2CuI+I2;
(5)Ksp(CuI)=c(Cu2+)![]() c(I-)=1.0×10-12;Ksp( CuSCN)= c(Cu2+)
c(I-)=1.0×10-12;Ksp( CuSCN)= c(Cu2+)![]() c(SCN-)=4.4×10-15,则沉淀完全转化后,溶液中c(SCN-):c(I-)≥
c(SCN-)=4.4×10-15,则沉淀完全转化后,溶液中c(SCN-):c(I-)≥![]() =
=![]() =4.4×10-3,
=4.4×10-3,
因此,本题正确答案为:4.4×10-3。
(6)A.Fe3+也能与I-反应生成I2,铜锌合金中含少量铁,则会造成测得的铜含量偏高,A项符合题意;
B.“沉淀”时生成I3-,会造成测得的铜含量偏低,B项不符合题意;
C.空气中的氧气能氧化碘离子生成碘单质,若转化后的溶液在空气中放置太久,则会造成测得的铜含量偏高,C项符合题意;
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水,对实验结果无影响,D项不符合题意。
因此,本题正确答案为:AC。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氧气的混合气体24g充分反应后,测得生成水18g,则原混合气体中氢气和氧气的质量比可能是( )
A.1:4B.1:11C.2:1D.1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和 Li4 Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是
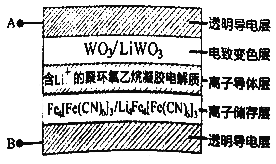
A. 当A外接电源负极时,此时Li+得到电子被还原
B. 当A外接电源正极时,膜的透射率降低,可以有效阻挡阳光
C. 当B外接电源正极时,离子导体层中Li+向下迁移
D. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4e-=Li4Fea[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含碳元素的化合物都是有机物
B.有机物都难溶于水
C.有机化合物与无机化合物的性质完全不同
D.大多数有机物受热易分解,但有的具有较强热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
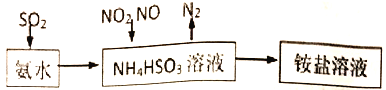
①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=__________mol/L(填确值)
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_____________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g)![]() 2CO2(g) △H3
2CO2(g) △H3
则2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g) △H4=______________________。
4HNO3(g) △H4=______________________。
②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因______________________。
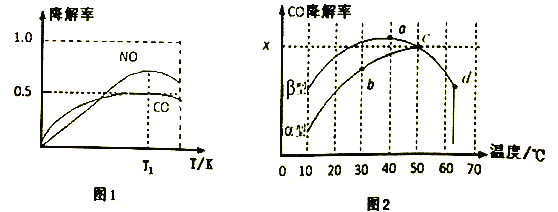
(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________________________________。(用含x的代数式表示)
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某石英晶体的平面结构示意图,它实际上是立体网状结构(可以看作晶体硅中的每个Si—Si键中插入一个O)。在石英晶体中,氧原子与硅原子的个数的比值和由硅原子、氧原子铁石构成的最小环上Si、O的原子个数之和分别是( )

A.1 8B.2 12C.1/2 8D.1/2 12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com