
在Al2(SO4)3 和MgSO4 的混合溶液中,滴加NaOH 溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中 Al2(SO4)3 与MgSO4 的物质的量浓度之比为( )
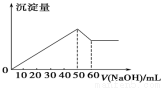
A. 1∶2 B. 2∶1 C. 6∶1 D. 3∶1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:选择题
由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
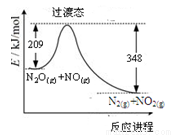
A.断键吸收能量之和大于成键释放能量之和
B.反应物总能量小于生成物总能量
C.N2O(g) +NO(g) =N2(g) +NO2(g)△H= -139kJ/mol
D.反应生成1 mol N2时转移4 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.相同质量的铝,分别于足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4L NH3与18g H2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:实验题
铁与冷水、热水均不反应,但与水蒸气可以反应。
资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570℃时,生成Fe3O4。
某研究性学习小组用如图所示实验装置,完成还原铁粉与水蒸气反应的实验,并分析研究产物的组成。

(1)肥皂液的作用是____________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了如下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色,有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中一定存在的物质是______________,由②的操作及现象,能否确定反应产物中不含有Fe3O4?________。(填“能”或“不能”)
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
下面有关 Na2CO3 与 NaHCO3 的叙述错误的是( )
A. Na2CO3 遇少量盐酸可转化为 NaHCO3
B.在水中的溶解度 Na2CO3 比 NaHCO3 大
C.与同浓度稀盐酸反应 Na2CO3 比 NaHCO3 剧烈
D. NaHCO3 与 Ca(OH)2 溶液混合会产生白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中实验班高一12月考化学卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合
4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
B.硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
D.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:填空题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO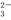 、CO
、CO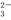 、HSO
、HSO 、HCO
、HCO 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO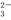
b.2HCOOH+CO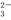 =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO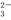
d.Cl2+H2O+2CO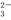 =2HCO
=2HCO +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
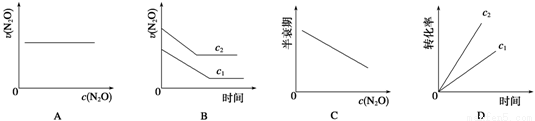
在一定条件下,N2O分解的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(N2O)/mol· | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
反应时间/min | 60 | 70 | 80 | 90 | 100 | |
c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是 ( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省淮安市高三12月考试化学试卷(解析版) 题型:填空题
(1)最近有人利用反应“2C4H10+13O2=8CO2+10H2O”制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化 二钇)的ZrO2(二氧化
二钇)的ZrO2(二氧化 锆)晶体,它在高温下能传导O2-。试回答下列问题:
锆)晶体,它在高温下能传导O2-。试回答下列问题:
固体电解质中的O2-向 极移动(填“正”或“负”);写出该燃料电池的电极反应式:电池正极 ;电池负极 。
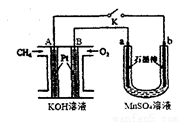
(2)用如图装置电解MnSO4溶液制MnO2时,A极为: 极, A电极电极反应式为 ;a极为: 极,电解MnSO4溶液制MnO2的化学方程式 。电解一段时间后, 溶液的pH将 (填“增大”、“减小”或“不变”)。
(3)精炼铜时,粗铜应与直流电源的____________极(填“正”或“负”)相连,阴极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com