
| A. | D元素处于元素周期表中第三周期ⅣA族 | |
| B. | 四种元素的原子半径:A<B<D<C | |
| C. | B、D的氧化物均为酸性氧化物 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
分析 A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;
若B为第三周元素,则2x=8,x=4,A为碳,C为硅,B和D找不出符合题意的元素,
A.根据D为硅,利用电子排布来分析其位置;
B.利用电子层数越多,半径越大,在同一周期从左到右原子半径在减小来分析;
C.CO不是酸性氧化物;
D.高温下,碳与二氧化硅能发生反应,常温下钠与水反应.
解答 解:A与C同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,设A的最外层电子数为x,若B为第二周期元素,则2x=2,x=1,则A为H,B与D同主族,原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,B为C,C为Na,D为Si,它们的核电荷数1+6+11+14=32,符合题意;
A.因硅有3个电子层,最外层电子数为4,则在周期表中的第三周期第ⅣA族,故A正确;
B.电子层数越多,半径越大,在同一周期从左到右原子半径在减小,则半径关系为A<B<D<C,故B正确;
C.二氧化碳和二氧化硅属于酸性氧化物,CO不是酸性氧化物,故C错误;
D.因C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,2Na+2H20═2NaOH+H2↑,即B单质能置换出D单质,C单质能置换出A单质,故D正确;
故选C.
点评 本题考查学生利用原子结构的关系来推断元素,然后利用元素的电子排布分析位置及半径,利用物质的结构和性质来分析解答问题,推断元素是解答本题的难点,应学会利用假设和验证的方法来解答.


科目:高中化学 来源: 题型:选择题
| A. | 体积分数75%的乙醇溶液常用于医疗消毒 | |
| B. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得各种烷烃、苯及其他衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
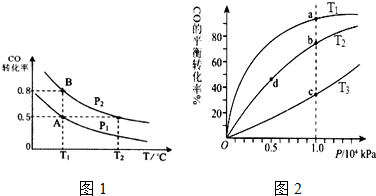
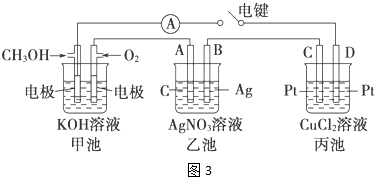
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
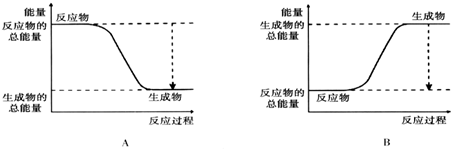
| A. | △H1,△H2都不变 | B. | △H1,△H2都增大 | C. | △H1,△H2都减小 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
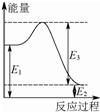 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
| 总能量变化 | ③放出热量 | ⑥484 | |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com