
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA
B.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA
C.7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA
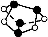
D.0.5 mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S—S键
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:选择题
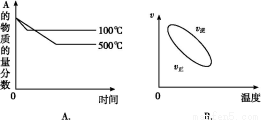
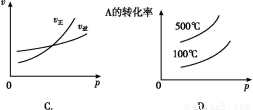
用来表示可逆反应:2A(g)+B(g) 2C(g) ΔH<0 的正确图像是下图中的( )
2C(g) ΔH<0 的正确图像是下图中的( )
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.熵减的吸热反应可能是自发反应
B.需要加热的化学反应,生成物的总能量一定高于反应物的总能量
C.使用催化剂既不会改变反应的限度又不会改变反应的焓变
D.已知2C(s)+2O2(g) 2CO2(g) ΔH1;
2CO2(g) ΔH1;
2C(s)+O2(g) 2CO(g) ΔH2,则ΔH1>ΔH2
2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题3离子反应练习卷(解析版) 题型:选择题
烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )
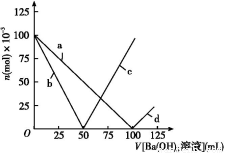
A.曲线a表示Ba2+的物质的量的变化
B.曲线c表示OH-的物质的量的变化
C.加入Ba(OH)2溶液50 mL反应的离子方程式为Ba2++OH-+H++SO42— BaSO4↓+H2O
BaSO4↓+H2O
D.加入Ba(OH)2溶液大于50 mL后,反应的离子方程式为OH-+H+ H2O
H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题3离子反应练习卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.过氧化钠固体与水反应:2O22—+2H2O 4OH-+O2↑
4OH-+O2↑
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42—恰好沉淀完全:2Al3++3SO42—+3Ba2++6OH- 2Al(OH)3↓+3BaSO4↓
2Al(OH)3↓+3BaSO4↓
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O Cl-+SO42—+2H+
Cl-+SO42—+2H+
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题2化学计量及其应用练习卷(解析版) 题型:选择题
36.5 g HCl溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度为1 mol/L
B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:w=36.5c/(1 000ρ)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题23实验方案的设计与评价练习卷(解析版) 题型:选择题
某化学兴趣小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案一:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案二:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和溶液B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,测得铜的质量分数偏大
C.方案一可能产生氢气,方案二可能剩余铜
D.实验室中方案二更便于实施
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题21化学实验基础练习卷(解析版) 题型:实验题
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
|
|
2 | 27.0 | 27.4 | 27.2 | 33.3 |
| |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
| |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
| |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题19烃的衍生物基础营养物质练习卷(解析版) 题型:选择题
NM 3是处于临床试验阶段的小分子抗癌药物,分子结构如图,下列说法中正确
3是处于临床试验阶段的小分子抗癌药物,分子结构如图,下列说法中正确
的是( )
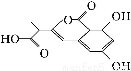
A.该有机物的化学式为C12H11O6
B.1 mol该有机物最多可以和3 mol NaOH反应
C.该有机物容易发生加成、取代、消去等反应
D.该有机物能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com