
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 == 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
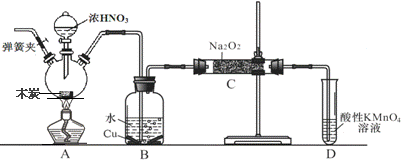

完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分 为CuFeS2)冶炼铜的主要流程如下:
为CuFeS2)冶炼铜的主要流程如下:
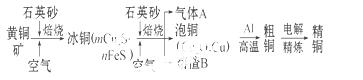
(1)气体A中的大气污染物可选用下列试剂中的 吸收。
a.浓硫酸 b.稀硝酸
c.NaOH溶液 d.氨水
(2)用稀硫酸浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),
检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c. 溶液中Cu2+向阳极移动
溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
1-对甲苯基-3-苯基-2-丙烯-1-酮(以下用M表示)是一种常见的工业原料,其结构简式为: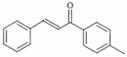 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):

已知:在稀碱作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
请回答下列问题:
(1)有机物B的名称为 。
(2)物质A、C的关系为 。
a.同系物 b.同分异构体 c.同素异形体 d.分子式相差1个CH2
(3)①~④反应中,属于加成反应的有 。
(4)反应②的化学方程式为 。
(5)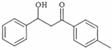 的同分异构体有许多。能与NaHCO3反应,且含有联苯基(
的同分异构体有许多。能与NaHCO3反应,且含有联苯基(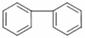 上1个氢原子被取代)的同分异构体共有 种。
上1个氢原子被取代)的同分异构体共有 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
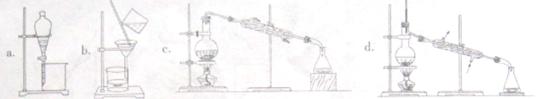
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料。在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷。

制备时的化学反应方程式及有关数据如下:
NaBr+H2SO4=HBr+NaHSO4
C4H9OH+HB rC4H9Br+H2O
rC4H9Br+H2O
| 物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
实验步骤:在装置A中加入2mL水,并小心加入28mL浓硫酸,混合均匀后冷却至室温。再依次加入18.5mL正丁醇和26g溴化钠,充分摇振后加入沸石,连接气体吸收装置C。将装置A置于石棉网上加热至沸腾,然后调节为小火使反应物保持平稳地回流。一段时间后停止加热,待反应液冷却后,拆去装置B,改为蒸馏装置,蒸出粗正溴丁烷。
请回答下列问题;
(1)仪器A的名称是________,仪器B的作用是________.操作中加入沸石的作用是________.
(2)装置C中盛装的液体是_______________,其作用是____________________.
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的___________制备纯净的正溴丁烷。
(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏_________(填“高”或“低”),试说出其中一种原因:_________________________.
(5)若最终得到13.6g纯净的正溴丁烷,则该实验的产率是_______________(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
己二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
 +8HNO3
+8HNO3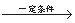 3HOOC(CH2)4COOH+8NO
3HOOC(CH2)4COOH+8NO +7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
+7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
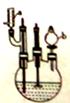
实验步骤:
I.在60mL三颈烧瓶中加入16.0mL50%硝酸(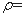 1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
II.首先将瓶内液体加热到50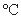 左右,开动搅拌器,滴入环己醇(
左右,开动搅拌器,滴入环己醇(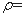 0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90
0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90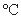 左右水浴加热20分钟,至反应完毕。
左右水浴加热20分钟,至反应完毕。
III.趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重。
IV.将粗产品在水中进行重结晶操作。
请回答下列问题:
(1)仪器a的名称是_________________。仪器b在使用前应_________________。
(2)偏钒酸铵的作用是_______________。
(3)反应完成后,趁热倒出反应液的目的是___________________。
(4)本实验中己二酸的理论产量为______________g。
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3=2NaNO2+NaNO3+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2 时,吸收液质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。
现测出肉桂酸甲酯的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰1︰1︰3。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图:
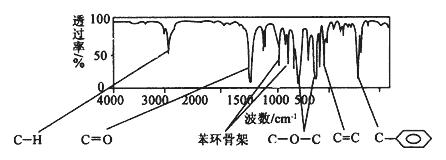
试回答下列问题。
(1)肉桂酸甲酯的结构简式为 。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示: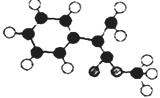
(图中球与球之间连线表示单键或双键)。
用芳香烃A 为原料合成G的路线如下:
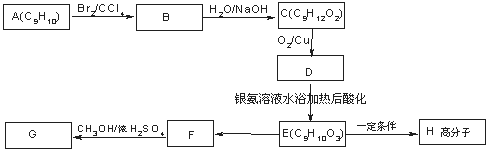
① 化合物E中的官能团有 (填名称)。
② A→B的反应类型是 ,E→F的反应类型是 ,
③ 书写化学方程式
B→C
C→D
E→H
④ 其中E的同分异构体甚多,其中有一类可用通式 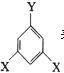 表示
表示
(其中X、Y均不为H),
试写出符合上述通式且能发生银镜反应的四种物质的结构简式:
、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
A.5.4g B.3.6g C.2.7g D.1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液一定显酸性的是( )
A.溶液中[OH-]>[H+]
B.滴加紫色石蕊试液后变红色的溶液
C.溶液中[H+]=10-6 mol·L-1
D.pH<7的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com