
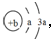 ,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题:
,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题: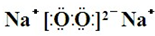 ,所含有的化学键类型为离子键和共价键.
,所含有的化学键类型为离子键和共价键.分析 X的原子结构示意图为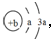 ,可知a=2,b=8,则X为O元素,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,应为Na,Z为地壳中含量最高的金属元素,应为Al,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,则W为N元素,G为NH4NO3,结合对应单质、化合物的性质以及元素周期率知识解答该题.
,可知a=2,b=8,则X为O元素,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,应为Na,Z为地壳中含量最高的金属元素,应为Al,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,则W为N元素,G为NH4NO3,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:(1)由以上分析可知X为O元素,W为N元素,位于周期表第二周期ⅤA族,同周期元素从左到右原子半径逐渐减小,且核外电子层数越多,原子半径越大,四种元素的原子半径从大到小的顺序是Na>Al>N>O,
故答案为:O;第二周期ⅤA族;Na>Al>N>O;
(2)Y2X2为浅黄色固体物质,应为过氧化钠,电子式为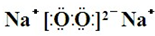 ,含有离子键和共价键,
,含有离子键和共价键,
故答案为: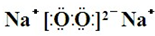 ;离子键和共价键;
;离子键和共价键;
(3)Y的最高价氧化物对应水化物为氢氧化钠,与铝的单质反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系应用,为高频考点和常见题型,侧重考查学生的分析能力,推断元素是解题关键,注意对元素周期律与元素化合物性质掌握.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 同温度、同浓度的NaCl溶液和氨水的导电能力 | |
| B. | 25℃时.pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 | |
| C. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| D. | 25℃时.pH均为3的盐酸和FeCI3溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若二氧化碳气体中混有少量的一氧化碳气体,可用点燃的方法除去 | |
| B. | 将铜粉中混有的少量铁粉除去,加入过量的CuSO4溶液充分反应后,过滤、洗涤干燥 | |
| C. | 将KNO3固体中混有的少量NaCl固体除去,可以用冷却KNO3的热饱和溶液、过滤即可 | |
| D. | 若氧气中混有少量的二氧化碳气体,可将混合气体通过足量的NaOH溶液后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe═Fe2++2e- | B. | Cu2++2e-═Cu | C. | Fe═Fe3++3e- | D. | Zn═Zn2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
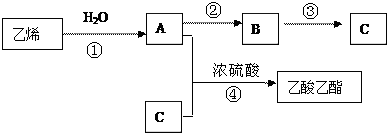
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
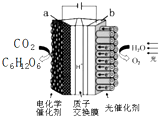 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )| A. | 该装置是新型化学电源装置 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:6CO2+24H+-24e-=C6H12O6+6 H2 O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 在强碱性溶液中,[Al(OH)4]-、HCO3-、Na+、Ca2+可能同时大量共存 | |
| C. | 铁船底镶嵌锌块,构成原电池,锌作负极,以防船体被腐蚀 | |
| D. | 用量筒量取10.mL 1.0mol/L的盐酸于100mL溶液瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=13的溶液中:NH4+、Na+、Cl-、CO32- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 能够与金属Cu常温下反应放出气体的溶液:Na+、Al3+、SO42-、K+ | |
| D. | 漂白粉的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
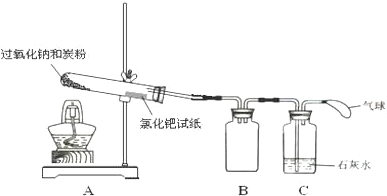
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com