
 乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.
乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.分析 ①根据氢离子移动方向知,右侧电极为正极,左侧电极为负极,负极上通入燃料;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应.
解答 解:①据氢离子移动方向知,右侧电极为正极,c口通氧气,左侧电极为负极,b口为负极上通入燃料乙醇,故答案为:O2;
②正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-=2H2O,负极上乙醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3CH2OH-12e-+3H2O=2CO2+12H+,
故答案为:O2+4H++4e-=2H2O;CH3CH2OH-12e-+3H2O=2CO2+12H+.
点评 本题综合考查原电池知识,为高频考点,侧重于学生的分析能力的考查,侧重于正负极的判断和电极方程式的书写,学生要注意相关基础知识的积累,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 常温下,4 g CH4含有NA个C-H共价键 | |
| C. | 10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8% | |
| D. | 25℃时,pH=12的1.0 LNaClO溶液中水电离出的OH-的数目为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
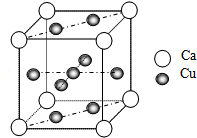 有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题:
有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温下一定能发生反应 | |
| C. | 放热反应不需要加热就能发生 | |
| D. | 吸热反应在常温下也能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
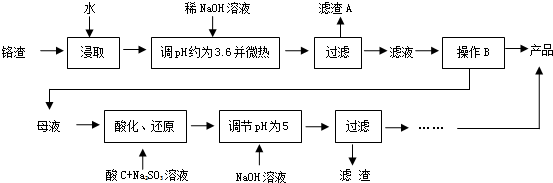
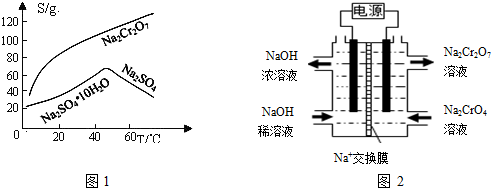
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30%的双氧水分解生成氧气的速率小于5%的双氧水 | |
| B. | 5℃时的双氧水分解生成氧气的速率小于50℃时的双氧水 | |
| C. | 加入MnO2后的双氧水分解生成氧气的速率小于未加MnO2时的双氧水 | |
| D. | 加入FeCl3后的双氧水分解生成氧气的速率小于未加FeCl3时的双氧水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com