
| A. | 稀硫酸 | B. | NaOH | C. | 氢氟酸 | D. | 浓盐酸 |
分析 玻璃的成分中含有二氧化硅,二氧化硅是酸性氧化物,能和强碱反应,能和氢氟酸反应,带玻璃塞的试剂瓶不能存放呈强碱性的物质.
解答 解:A.稀硫酸溶液不与二氧化硅发生反应,所以稀硫酸溶液能用带玻璃塞的玻璃瓶保存,故A正确;
B.氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,故B错误;
C.氢氟酸和二氧化硅反应生成四氟化硅,所以不能用玻璃瓶盛放氢氟酸,要用塑料瓶盛放,故C错误;
D.浓盐酸呈酸性,不和二氧化硅反应,所以可以带玻璃塞的试剂瓶盛放,故D正确.
故选BC.
点评 本题考查了化学试剂的存在,难度不大,注意玻璃的成分中含有二氧化硅,二氧化硅能和强碱或氢氟酸反应,所以强碱溶液不能用带玻璃塞的试剂瓶存放,碱式滴定管下端不是玻璃塞是橡胶管.


科目:高中化学 来源: 题型:选择题
| A. | 8g CH4所含共价键数目为2NA | |
| B. | 0.5NA 个氯气分子与水反应转移电子数为0.5NA | |
| C. | 50mL12mol/L盐酸与足量的MnO2共热,转移的电子数为0.3NA | |
| D. | 1 L0.2mol/L的Na2S溶液中离子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、CO32-、SO42- | D. | K+、Na+、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
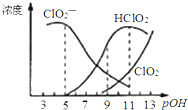 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 亚氯酸钠在碱性条件下较稳定 | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c( ClO2)>c( Cl-) | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸时,先产生沉淀又溶解 | |
| B. | 都能透过半透膜 | |
| C. | 加热、蒸干、灼烧,最终都有Fe2O3生成 | |
| D. | 都有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | pH=1的溶液:NH4+、Al3+、SO42-、Br- | |
| C. | 0.1 mol•L-1FeCl3溶液:NH4+、H+、I-、SCN- | |
| D. | 常温下,在c(H+)水•c(OH-)水=10-26的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com