
| 高温 |
| 1400℃ |
| 约3000℃ |
| 消耗量 |
| 起始量 |
| 高温 |
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
| 高温 |
| 3 |
| 5 |


科目:高中化学 来源: 题型:
| A、酒精在空气中燃烧 |
| B、硫酸与氢氧化钠中和反应 |
| C、金属镁与盐酸反应 |
| D、Ba(OH)2?8H2O与NH4Cl固体混合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
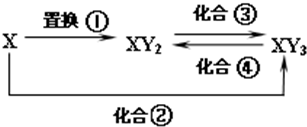 元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,
元素X的单质、Y单质及X与Y形成的化合物能按如下图所示的关系发生转化,图中化合反应均为与X或Y单质的反应,且Y单质为气体,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上由硅的氧化物制备硅单质 |
| B、生活中使用明矾净水,除去水中的悬浮的微小颗粒 |
| C、漂白粉用作疫区的环境消毒 |
| D、过氧化钠用作呼吸面具的供氧剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com