
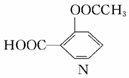
| A. | 分子式是C9H8O4 | |
| B. | 属于酯类化合物 | |
| C. | 1 molN 可以与1 mo1Na2CO3充分反应生成lmolCO2 | |
| D. | 一定条件下可发生加成反应和取代反应 |
分析 A.根据结构简式确定分子式;
B.该分子中含有酯基和羧基,具有酯和羧酸的性质;
C.2mol羧基能和1molNa2CO3完全反应生成1mol二氧化碳;
D.羧基和酯基能发生取代反应,苯环在一定条件下能发生加成反应.
解答 解:A.根据结构简式确定分子式为C9H8O4,故A正确;
B.该分子中含有酯基和羧基,具有酯和羧酸的性质,所以属于酯类物质,故B正确;
C.2mol羧基能和1molNa2CO3完全反应生成1mol二氧化碳,该分子中只有一个羧基,所以2molN 可以与1 mo1Na2CO3充分反应生成lmolCO2,故C错误;
D.羧基和酯基能发生取代反应,苯环在一定条件下能发生加成反应,所以该物质能发生取代反应和加成反应,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酯和羧酸的性质,注意C中羧基和碳酸钠反应关系,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入适量的 AgNO3溶液,有白色沉淀产生,则原溶液中一定有 Cl- | |
| B. | 向某溶液中加入稀盐酸无明显现象,再加 AgNO3溶液有白色沉淀产生,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入 BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入稀盐酸,无明显现象,再加 BaCl2溶液有白色沉淀产生,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min 后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 常温下,向浓硝酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硝酸反应 |
| C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点;氧化铝>铝 |
| D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既可与NaOH溶液反应也可与HF溶液反应均生成盐和水,所以SiO2属于两性氧化物 | |
| B. | SO2和NH3分别通入水中其水溶液均可以导电,所以SO2和NH3均属于电解质 | |
| C. | “水滴石穿”不仅包含着“量变到质变”的哲学思想,同时也包含了物理和化学变化 | |
| D. | 14CO2和12CO2具有相同的元素组成,所以14CO2、12CO2属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:向饱和氯化铁溶液中滴加氨水 | |
| B. | 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 | |
| C. | 检验食盐中是否含有KIO3:取少量食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 证明在相同温度下Ksp[Mg(OH)2]>Ksp[Fe(OH)3]:向10mL0.2 mol•L-1NaOH溶液中滴入2滴0.1 mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol•L-1 FeCl3溶液,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | B. | 气态氢化物的沸点:Y>W | ||
| C. | Y与W可以形成多种二元化合物 | D. | p、q与r的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120℃时,若反应前混合气体共NA个分子,反应后气体分子可能大于NA | |
| B. | 0℃时,若生成2.24L气体,则转移电子数一定为0.8NA | |
| C. | 若NA个CH4分子参加反应,则有 2NA个O-H生成 | |
| D. | 0℃时,若NA个CH4分子和足量O2完全反应,则生成气体体积为67.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
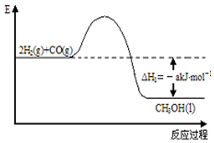 能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热
能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热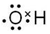 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com