
| A、A>B>E>D |
| B、A>B>D>E |
| C、D>E>A>B |
| D、D>A>B>E |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A 基态原子有3个能级,各能级中电子数相等 |
| B 基态原子核外有13种不同运动状态的电子 |
| C与B处于同一周期,且原子在该周期中电负性最大 |
| D D4+的核外电子排布与氩原子相同 |
| E 是ds区原子序数最小的元素 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沾附在试管内壁上的油脂,用热碱液洗涤 |
| B、蒸馏操作时应将温度计的水银球插入液面下 |
| C、苯酚有毒,若其浓溶液不慎沾到皮肤上,应立即用NaOH溶液冲洗 |
| D、向蔗糖溶液中加入几滴稀硫酸,水浴加热,再向其中加入银氨溶液,可产生银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲、乙、丙、丁 |
| B、乙、甲、丙、丁 |
| C、乙、甲、丁、丙 |
| D、丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 试剂 | 判断方法 |
| A | 稀硝酸 | 是否生成蓝色溶液 |
| B | 稀硫酸 | 固体物质是否完全溶解 |
| C | 浓硫酸 | 是否有无色气体生成 |
| D | 稀盐酸 | 是否生成蓝色溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
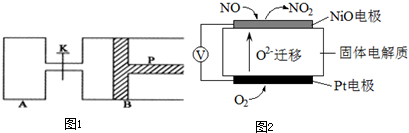
查看答案和解析>>
科目:高中化学 来源: 题型:
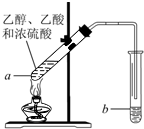 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com