
 �Ƽ��仯������й㷺����;��
�Ƽ��仯������й㷺����;��| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
| pH | 8.8 | 9.7 | .6 | 0.3 | 11.1 |
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
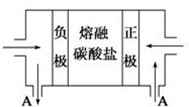
���� ��1���ƻ�ѧ���ʱȽϻ��ã���ҵ�ϲ��õ�ⷨ��ȡ�ƣ���������Ȼ��ƺͽ����ƺ��������Ƶ��۵�ϵͣ�Һ̬�ƿ����˷�Ӧ�ѵĴ��Ƚ��ʣ�
��2����ȼ�ϵ���У�������ȼ��ʧ���ӷ���������Ӧ���������������õ��ӷ�����ԭ��Ӧ������������ʽ��Ӽ���һ����̼ȼ�շ���ʽ�����ݵ缫��Ӧ�������ɣ�
��ͨ����ɫ��Ӧ���Լ���̼�����е���Ԫ�أ�
��3��Խ����ˮ����Σ�Խ����������ӣ���ͬŨ�ȵ�������Һ��pHԽ�����ε�ˮ��̶�Խ��Ũ����ͬ����ϡ����ͬ�ı���������Խǿ������pH�仯Խ��
��4���ٸ��������ˮ��͵���غ���������ע�������ˮ�������ģ�
�ڿ�ʼ����ʱpHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ�����
��� �⣺��1�������ƱȽϻ��ã���ҵ��ͨ��ͨ����������Ȼ��ƻ�ý����ƣ���Ӧ����ʽΪ��2NaCl�����ڣ�$\frac{\underline{\;���\;}}{\;}$2Na+Cl2�������ڽ����Ƶ��۵�ϵͣ���Һ̬�ƿ����˷�Ӧ�ѵĴ��Ƚ��ʣ�
�ʴ�Ϊ����ⷨ��2NaCl�����ڣ�$\frac{\underline{\;���\;}}{\;}$2Na+Cl2����Һ̬�ƿ����˷�Ӧ�ѵĴ��Ƚ��ʣ�
��2���ٸ�ȼ�ϵ�ص��ܷ�ӦΪ��2CO+O2=2CO2��ͨ��������CO2�Ļ������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2CO2=2CO32-��ͨ��CO��һ��Ϊԭ��صĸ���������������Ӧ���缫��ӦʽΪ��2CO-4e-+2CO32-=4CO2���ɵ缫��Ӧ��֪��ع���ʱ�μ�ѭ��������ΪCO2��
�ʴ�Ϊ��O2+4e-+2CO2=2CO32-��CO2��
�ڿ�ͨ����ɫ��Ӧ����Na2CO3����Ԫ�أ���������Ϊ��ȡһ���ྻ�IJ�˿պȡ̼���Ʒ�ĩ��̼������Һ�����ھƾ������������գ��۲�������ɫΪ��ɫ��
�ʴ�Ϊ��ȡһ���ྻ�IJ�˿պȡ̼���Ʒ�ĩ��̼������Һ�����ھƾ������������գ��۲�������ɫ��
��3��Խ����ˮ����Σ�Խ����������ӣ���ͬŨ�ȵ�������Һ��pHԽ�����ε�ˮ��̶�Խ����������ˮ�������̼���ƣ�����������������ӵ���������CO32-��Ũ����ͬ����ϡ����ͬ�ı���������Խǿ������pH�仯Խ��HCN��HClO��CH3COOH��H2CO3����������Դ�С˳����CH3COOH��H2CO3��HClO��HCN��������Һ��pH�仯�����Ǵ��ᣬ��ѡc��
�ʴ�Ϊ��CO32-��c��
��4����300mL 1mol•L-1��NaOH�����ʵ���=1mol/L��0.3L=0.3mol����״����4.48LSO2�����ʵ���=$\frac{4.48L}{22.4L/mol}$=0.2mol�������������ƺͶ�������Ӧ����ʽΪ2SO2+3NaOH=Na2SO3+NaHSO3+H2O����Һ�����������ˮ���ʹ��Һ�ʼ��ԣ���c��OH-����c��H+�������������ˮ����������������ӣ�����c��HSO3-����c��SO32-��������ˮ��̶Ƚ�С������c��SO32-����c��OH-��������Һ�и�����Ũ�ȴ�С˳���ǣ�c��Na+����c��HSO����c��SO����c��OH-����c��H+����
�ʴ�Ϊ��c��Na+����c��HSO����c��SO����c��OH-����c��H+����
��pHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ���������Cu2+�ȳ�����KSP[��Fe��OH��2]��KSP[��Mg��OH��2]��
�ʴ�Ϊ��Cu2+������
���� ���⿼��������Ũ�ȴ�С�Ƚϡ���ҵ��ȡ����Na�ķ�����ȼ�ϵ�ص缫��Ӧʽ��д��������ʵĵ��롢�ε�ˮ�⡢Ksp��Ӧ�õ�֪ʶ�㣬֪ʶ��϶࣬��Ŀ�Ѷ��еȣ�ע�������Һ������Ũ�ȴ�С�Ƚϵķ�������ȷ���ԭ�����ε�ˮ��ԭ��Ϊ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1��д���ɼױ��Ʊ�TNT�Ļ�ѧ��Ӧ����ʽ
��1��д���ɼױ��Ʊ�TNT�Ļ�ѧ��Ӧ����ʽ ��
�� ��
�� ��Y�Ľṹ��ʽΪ��
��Y�Ľṹ��ʽΪ�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ǿ����ڴ�����Һ�У�CaCO3+2CH3COOH�TCa2++2CH3COO-+CO2��+H2O | |
| B�� | ����ͭ������ķ�Ӧ��CuO+2H+�TCu2++H2O | |
| C�� | ��Ͷ�뵽ˮ�У�2Na+2H2O�T2Na++2OH-+H2�� | |
| D�� | �������廯�Ʒ�Ӧ��Cl2+2Br-�T2 Cl-+2Br |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
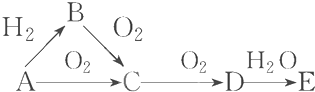
 ��֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʣ�AΪ�����������������������;���Ľ������ʣ�������B�ǻ���ɫ���壬CΪ��ɫ���壮��һ���������ת���Ĺ�ϵ��ͼ2��ʾ��
��֪A��B��CΪ��ѧ��ѧ�г����ĵ��ʣ�AΪ�����������������������;���Ľ������ʣ�������B�ǻ���ɫ���壬CΪ��ɫ���壮��һ���������ת���Ĺ�ϵ��ͼ2��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C$\stackrel{�ڿ����е�ȼ}{��}$CO$\stackrel{CuO����}{��}$CO2$\stackrel{NaOH��Һ}{��}$Na2CO3 | |
| B�� | Cu$\stackrel{AgNO_{3}��Һ}{��}$Cu��NO3��2$\stackrel{NaOH��Һ}{��}$Cu��OH��2 | |
| C�� | Fe$\stackrel{��ȼ}{��}$Fe2O3$\stackrel{H_{2}SO_{4}��Һ}{��}$Fe2��SO4��3��Һ | |
| D�� | CaO$\stackrel{H_{2}O}{��}$Ca��OH��2��Һ$\stackrel{Na_{2}CO_{3}}{��}$NaOH��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com