
| �ѡ�������֪ | �ơ����������� | |||||||||
| A | ����������Һ��ͨCO2���壺 Ca2++2ClO-+CO2+H2O�TCaCO3��+2HClO |
����������Һ��ͨSO2���壺 Ca2++2ClO-+SO2+H2O�TCaSO3��+2HClO | ||||||||
| B | �ö��Ե缫�����ͭ��Һ�� 2Cu2++2H2O
|
��ͭ�缫�������ͭ��Һ�� 2Cu2++2H2O
| ||||||||
| C | ϡ������Ba��OH��2��Һ��Ӧ��pH=7ʱ�� 2H++SO42-+Ba2++2OH-�TBaSO4��+2H2O |
����������Һ��Ba��OH��2��Һ��Ӧ��pH=7ʱ�� 2H++SO42-+Ba2++2OH-�TBaSO4��+2H2O | ||||||||
| D | Ba��OH��2��Һ��ε�������������Һ�����������ﵽ���ֵ�� 2Ba2++4OH-+Al3++2SO42-�T2BaSO4��+AlO2-+2H2O |
Ba��OH��2��Һ��ε������������Һ�����������ﵽ���ֵ�� 2Ba2++4OH-+Al3++2SO42-�T2BaSO4��+AlO2-+2H2O |
| A��A | B��B | C��C | D��D |
| ||


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.241 |
| B��0.259 |
| C��0.403 |
| D��0.487 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����д���HCO3-�ij�������Һ�У�K+��C6H5O-��Cl-��Na+ |
| B�������������Ӧ�ų���������Һ�У�K+��NO3-��Cl-��Fe2+ |
| C��������ˮ�������c��H+��?c��OH-��=10-20����Һ�У�Na+��ClO-��S2-��NH4+ |
| D��pH=7����Һ��Fe3+��Mg2+��SO42-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������ᰱ���Һ�м�������������������Һ��NH4++OH-=NH3?H2O |
| B����Ͷ����ˮ�У�Na+2H2O=Na++2OH-+H2�� |
| C�����Ȼ�����Һ�м��������ˮ��Al3++3NH3?H2O=Al��OH��3��+3NH4+ |
| D��ͭ˿����ϡ�����У�Cu+NO-3+4H+=Cu2++NO��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
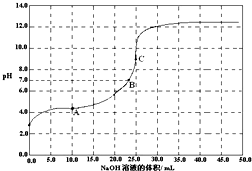 ����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������
����ʱ����0.1000mol/L NaOH �ζ� 25.00mL 0.1000mol/LijһԪ��HX���ζ�������pH �仯������ͼ��ʾ������˵����ȷ���ǣ�������| A���ζ�ǰ������c��H+�� ���ڼ���c��OH-�� |
| B����A�㣬c��Na+����c��X-����c��HX����c��H+����c��OH-�� |
| C����B�㣬����ǡ����ȫ��Ӧ |
| D����C�㣬c��X-��+c��HX��=0.05 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��65 | B��184 |
| C��195 | D��212 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����ͼ��ʾ�������ת����ϵ�У�A��һ�ֹ��嵥�ʣ�E��һ�ְ�ɫ������ˮ�����ʣ��ݴ���գ�
����ͼ��ʾ�������ת����ϵ�У�A��һ�ֹ��嵥�ʣ�E��һ�ְ�ɫ������ˮ�����ʣ��ݴ���գ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ũ�ȵ������ǿ����ǿ����Һ��Ϻ���Һ��pH=7 |
| B����10 mL pH=a��������100 mL pH=b��Ba��OH��2��Һ��Ϻ�ǡ���кͣ���a+b=13 |
| C��pH=10��Ba��OH��2��Һ��pH=13��NaOH��Һ�������Ϻ���Һ��pH=10.7����֪lg 2=0.3�� |
| D��pH=2��������pH=12�İ�ˮ�������Ϻ�������Һ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com