
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
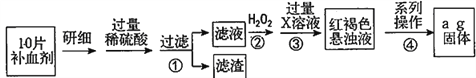
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
【答案】 Fe3+ 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3OH-= Fe(OH)3↓[或Fe3++3NH3·H2O = Fe(OH)3↓+3NH4+] 洗涤 冷却至室温 )0.07a或![]() 及其化简形式,如
及其化简形式,如![]() )
)
【解析】(1)向操作①的滤液中滴加KSCN溶液后变为红色,说明该滤液中含有Fe3+。(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,则②中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓或Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,即过滤、洗涤、灼烧、冷却至室温、称量。(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量为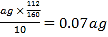 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
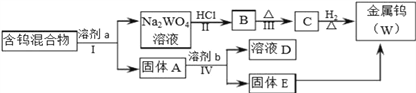
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未 检 出 | 未 检 出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是____________________________________________。
(2)WO3既属于金属氧化物,也属于__________(填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是__________________________________________________。
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是___________________________。
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是_______________,固体E中含有的物质是_______________,D中的溶质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:
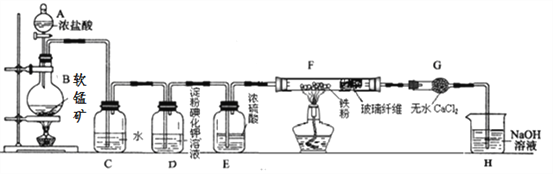
(1)取适量软锰矿置于烧瓶中,加入足量浓盐酸并加热,烧瓶中发生的化学反应为:MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
(2)若将干燥的有色布条放入C中,观察到的现象是 ______ ,原因是 ______________ (用化学方程式和文字回答);
(3)实验中观察到D溶液变蓝色,写出D装置中发生反应的离子方程式 ____________ ;
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
实验方法 | 实验现象 | 实验结论 |
1.取反应初始阶段(氯气不足量)F中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液装入两只试管中,①加入KSCN溶液,②加入KMnO4溶液 | ①KSCN溶液显红色 ②KMnO4溶液不褪色 | (不填) |
2.取充分反应后(氯气通入足够长时间)F中产物,溶于水中,加入KMnO4溶液 | KMnO4溶液不褪色 |
根据实验现象,得出实验结论,写出氯气与Fe粉共热时发生反应的化学方程式______;
(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)已知反应2I-+2Fe3+=I2+2Fe2+,反应中还原剂是_________,氧化性Fe3+______I2 (填“ < ”或“ > ”) 。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,若转移3mol电子,则所产生的氧气在标准状况下的体积为___________L。
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是__。
A.m=y,R3+是还原剂 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(4)用双线桥标出反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目_________。
(5)氯气和石英砂、碳粉共热可发生反应:SiO2+2C+2Cl2![]() SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图 .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4 , 该元素的名称是 .
(4)已知下列化学键的键能:Si﹣O:460kJ/mol,Si﹣Si:175kJ/mol,O=O:498kJ/mol,则反应:Si+O2=SiO2的反应热△H= .
(5)写出二氧化硫和水合氢离子中S原子,O原子分别采用和杂化形式,其空间构型分别为和 .
(6)用氢键表示法表示HF水溶液中的所有氢键、、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
A. 除去CO2中的少量HCl:通入NaOH溶液
B. 除去NaCl溶液中的少量MgCl2:加入适量KOH溶液,过滤
C. 除去KCl溶液中的少量K2CO3:加入适量的盐酸
D. 除去N2中的少量O2:通过灼热的CuO粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl溶液的pH和稀HCl的pH均为5,其中由水电离出的c(H+)分别为x molL﹣1和y molL﹣1 , 则x与y的比值正确的是( )
A.1
B.10
C.104
D.10﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质进行的分类正确的是( )
A.纯碱、烧碱都属于碱B.CuSO4·5H2O属于电解质
C.凡能电离出H+的化合物都属于酸D.盐类物质一定含有金属阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com