
有些化学反应的化学能能直接转化成电能
Ⅰ.利用Fe+CuSO
4=FeSO
4+Cu反应,设计一个原电池:
(1)在右框中画出装置图(标明电解质溶液、正、负极和电极材料);
(2)下列说法中,正确的是
B、D
B、D
.(填字母)
A.电解质溶液中阳离子向负极移动 B.电子通过外导线由负极流向正极
C.当导线中有1mol电子通过时,理论上正极放出1g气体
D.若所选电极的质量相等,理论上两极质量差为60g,导线中有1mol电子通过
Ⅱ.三套装置如图所示,A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸.
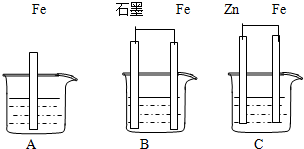
(1)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为
B、A、C
B、A、C
;
(2)若C中电解质溶液是氯化钠溶液,则Fe电极的电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;
Ⅲ.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H
2O
2Ni(OH)
2+Cd(OH)
2已知Ni(OH)
2和Cd(OH)
2均难溶于水但能溶于酸.
(1)以下说法中正确的是
②④
②④
.
①以上反应是可逆反应;
②以上反应不是可逆反应;
③充电时化学能转变为电能;
④放电时化学能转变为电能.
(2)废弃的镍镉电池已成为重要的环境污染物,资料表明一节废镍镉电池可以使一平方米面积的耕地失去作用价值.在酸性土壤中这种污染特别严重,这是因为
Ni(OH)2、Cd(OH)2可被酸溶解,生成Ni2+和Cd2+
Ni(OH)2、Cd(OH)2可被酸溶解,生成Ni2+和Cd2+
(3)另一种常用的电池是锂电池,锂是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为Li+MnO
2=LiMnO
2.
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液
2Li+2H2O═2LiOH+H2↑
2Li+2H2O═2LiOH+H2↑
(请用化学方程式表示其原因).

 有些化学反应的化学能能直接转化成电能
有些化学反应的化学能能直接转化成电能

