
| A. | 蒸馏法 | B. | 电渗析法 | C. | 过滤法 | D. | 离子交换法 |
科目:高中化学 来源: 题型:推断题
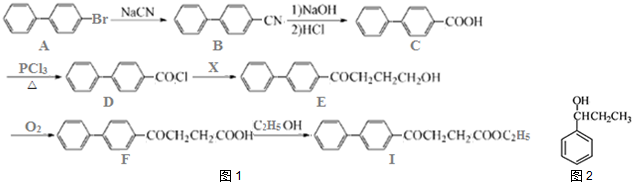
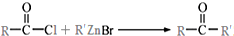
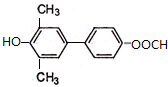 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸要保存在塑料瓶中 | |
| B. | 新制的氯水要保存在无色细口瓶中,并放置在光亮处 | |
| C. | 少量液溴要保存在棕色细口瓶中,并在液溴面上加水封 | |
| D. | 单质碘要保存在棕色广口瓶中,并放置在阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
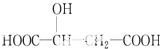
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
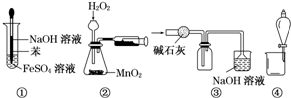
| A. | 图①可以用来制取Fe(OH)2沉淀 | |
| B. | 图②可以用来测定化学反应速率 | |
| C. | 图③可以用来收集一瓶纯净的SO2 | |
| D. | 图④可以用来分离水和乙醇的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
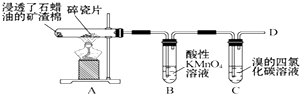
| A. | A装置中碎瓷片的作用是做催化剂 | B. | B、C试管中的溶液均要褪色 | ||
| C. | B、C试管中均发生的是加成反应 | D. | 在D处点燃前,一定要先验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3) | B. | (1)(4) | C. | (2)(3) | D. | (2)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl浓═Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2 Na++2OH-═Na2SiO3+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
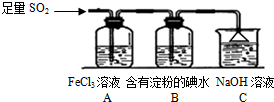 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com