
分析 (1)设参加反应的NO为xmol,用三段式表示出平衡时各组分物质的量,恒温恒容下,压强之比等于气体物质的量之比,据此列方程计算x的值,进而计算NO的转化率;
(2)结合(1)的计算可知平衡时各组分物质的量,计算平衡时各组分物质的量浓度,代入平衡常数表达式K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$计算.
解答 解:(1)设参加反应的NO为xmol,则:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
开始(mol):2 2 0 0
转化(mol):x x 0.5x x
平衡(mol):2-x 2-x 0.5x x
测得达到平衡后容器的压强是起始压强的$\frac{4}{5}$,则$\frac{(2-x+2-x+0.5x+x)mol}{2mol+2mol}$=$\frac{4}{5}$,解答x=1.6,
故NO的转化率为$\frac{1.6mol}{2mol}$×100%=80%,
答:NO的转化率为80%.
(2)平衡时NO、CO的浓度均为$\frac{(2-1.6)mol}{2L}$=0.2mol/L,N2的浓度为$\frac{0.5×1.6mol}{2L}$=0.4mol/L,CO2的浓度为$\frac{1.6mol}{2L}$=0.8mol/L,故平衡常数K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.4×0.{8}^{2}}{0.{2}^{2}×0.{2}^{2}}$=160,
答:该温度下平衡常数为160.
点评 本题考查化学平衡有关计算、平衡常数计算,难度不大,注意掌握三段式解题法在化学平衡计算中的应用.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
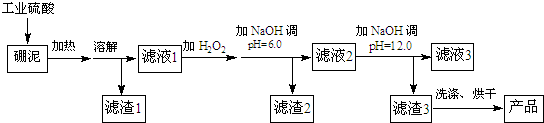
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 Al(OH)3 | 2.7 3.7 | 3.7 4.7 |
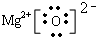 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
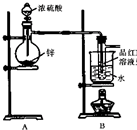 某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究.| 仪器标号 | C | D | E | F | G |
| 仪器 | 洗气瓶 | 洗气瓶 | 硬质玻璃管,加热 | 干燥管 | 干燥管 |
| 仪器中所加物质 | NaOH溶液 | 浓硫酸 | CuO粉末 | 试剂X | 无水CaCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
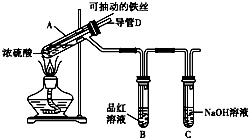 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其他条件不变时,若增大压强,则物质Y的转化率减小 | |
| D. | 其他条件不变时,若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | NH4Cl的电子式: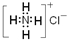 | |
| C. | 原子核内有10个中子的氧原子${\;}_{8}^{18}O$ | |
| D. | 次氯酸分子结构式 H-Cl-O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com