
| ||
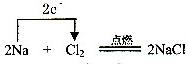 ,
, ;Na;
;Na;

科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中的上层液体应由下口倒出 |
| B、用加热分解的方法不能区分碳酸钠和碳酸氢钠两种固体 |
| C、配制0.1000mol?L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 |
| D、检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
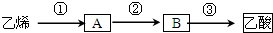
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 容器体积/L | 温度/℃ |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg | O | MgO | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、SO42- |
| B、K+、Cl-、CO32- |
| C、Al3+、NO3-、SO42- |
| D、Fe3+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸溶于水的过程属于放热反应 |
| B、既有化学键断裂又有化学键生成的过程一定属于化学反应 |
| C、物质导电的过程一定是物理变化 |
| D、同分异构体之间的相互转化一定是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com