
分析 常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,氯化铵和氢氧化钠反应生成一水合氨和氯化钠,反应的定量关系可知氯化铵过量,溶液中为NH3•H2O、NaCl、NH4Cl溶质,依据化学方程式计算判断溶液中的溶质微粒,结合电荷守恒计算判断问题;
(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,一水合氨形成的化学平衡,水的电离平衡;
(2)依据溶液中平衡状态和存在的微粒分析,溶液中为NH3•H2O、NaCl、NH4Cl溶质和溶剂水,一水合氨电离出铵根离子和氢氧根离子,氯化钠完全电离出钠离子和氯离子,氯化铵电离出铵根离子和氯离子,水电离出氢离子和氢氧根离子;
(3)钠离子、氯离子在溶液中不发生变化,这些微粒中浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
(4)依据物料守恒分析,氮元素守恒,溶液中氮元素的存在形式为一水合氨和铵根离子,物质的量之和为0.01mol的两种微粒是NH4+、NH3•H2O.
解答 解:常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中为NH3•H2O、NaCl、NH4Cl溶质,
(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨是弱电解质存在电离平衡,NH3•H2O?NH4++OH-,溶液中溶剂水也是弱电解质存在电离平衡,H2O?OH-+H+,该溶液中除H2O的电离平衡外还存在的平衡体系是水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨的电离平衡,NH3•H2O?NH4++OH-,
故答案为:水解平衡,NH4++H2O?NH3•H2O+H+,电离平衡,NH3•H2O?NH4++OH-;
(2)溶液中为NH3•H2O、NaCl、NH4Cl溶质和溶剂水,溶液中存在的微粒为NH4+、OH-、H+、Na+、Cl-、NH3•H2O、H2O,共7种微粒;
故答案为:7;
(3)这些微粒中,铵根离子水解,一水合氨发生电离,改变了溶液中铵根离子浓度、一水合氨浓度、氢离子浓度和氢氧根离子浓度,而氯离子、钠离子物质的量不变,所以浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+;
故答案为:Cl-;Na+;
(4)物料守恒分析,0.01mol NH4Cl溶于0.002mol NaOH溶于水配成1L溶液,铵根离子结合氢氧根离子生成一水合氨,一水合氨电离书写铵根离子和氢氧根离子,根据物料守恒可知,氮元素的存在形式为NH4+、NH3•H2O,但溶液中存在的氮元素物质的量一定为1mol,则物质的量之和为0.01mol的两种微粒是NH4+、NH3•H2O;
故答案为:NH4+、NH3•H2O.
点评 本题考查了弱电解质电离,盐类水解原理,明确影响平衡移动的因素、电解质溶液中电荷守恒、物料守恒,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | n+4 | B. | n+6 | C. | n+8 | D. | n+10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-1 | |
| B. | N2H4+O2═N2+2H2O△H=-1 068.8 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1 | |
| D. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
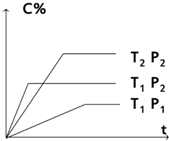 对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,
对于反应mA (g)+nB (g)?pC(g) 有如图所示的关系,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 48gO3含有的氧原子数目为NA | |
| B. | 常温常压下,22.4L Cl2含有的分子数目为NA | |
| C. | 1molAl与足量氢氧化钠溶液完全反应时失去的电子数目为3NA | |
| D. | 1mol•L-1K2CO3溶液中含有的钾离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
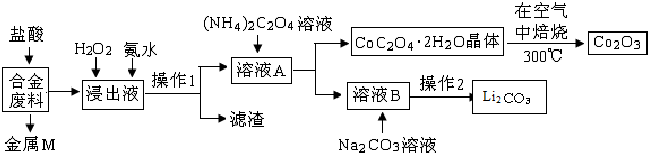
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
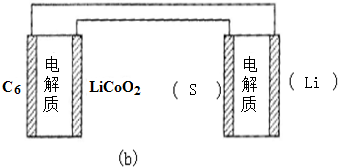 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.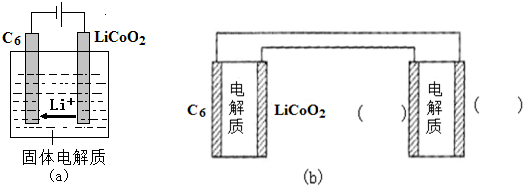
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 开始蒸馏时,应该先通冷凝水,再加热;蒸馏完毕,应该先撤酒精灯再停通冷凝水 | |
| C. | 使用托盘天平称量物质时,先取小砝码,再依次取较大的砝码 | |
| D. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com