
铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
编号 | ① | ② | ③ | ④ |
稀硝酸体积/mL | 100 | 200 | 300 | 400 |
剩余金属/g | 18.0 | 9.6 | 0 | 0 |
NO体积/mL | 2240 | 4480 | 6720 | V |
下列计算结果正确的是 (? )
A.①中溶解了5.6gFe???????????????????? B.硝酸的浓度为0.4mol/L
C.②中溶解了9.6gCu???????????????????? D.④中V=8960
D
【解析】
试题分析:根据题给数据可知,实验①、②都有金属剩余,则反应后的溶液中不可能含有硝酸铁,溶液中金属离子为亚铁离子和铜离子,实验②是在实验①的基础上加入100mL硝酸,参加反应的金属的质量为8.4g,生成NO的体积为2240mL,物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为0.1mol×(5—2)/2=0.15mol,参加反应金属的摩尔质量为56g/mol,该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算参加反应Fe的物质的量、硝酸的物质的量,根据m=nM计算参加反应Fe的质量,根据c=nV计算硝酸的物质的量浓度;在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为2240mL,物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量0.15mol,Cu的质量9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,则加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,硝酸与溶液中亚铁离子反应生成NO,根据亚铁离子的物质的量,利用电子转移守恒计算该阶段生成NO的物质的量,再根据V=nVm计算该阶段生成NO的体积,进而计算V的值。A、根据上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应铁的物质的量为0.15mol,质量为8.4g,错误;B、根据上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为0.1mol,根据方程式可知,参加反应的硝酸的物质的量为0.4mol,故硝酸的物质的量浓度4mol/L,错误;C、由上述分析可知,实验②中参加反应的金属为Fe,Cu没有参加反应,错误;D、由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量0.2mol,由3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守恒可知,生成NO的物质的量0.1mol,体积为2240mL,V=6720+2240=8960,正确。
考点:考查根据化学方程式计算、电子守恒法计算。


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:阅读理解
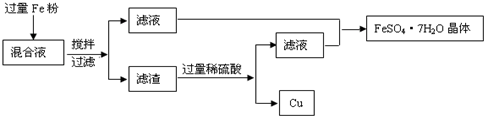

查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省湛江二中高三(上)第二次月考化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com