
 某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:SO2>I->Fe2+,用如图所示装置进行实验(加热和夹持装置已略,气密性已检验).
某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:SO2>I->Fe2+,用如图所示装置进行实验(加热和夹持装置已略,气密性已检验).分析 (1)二氧化锰和浓盐酸在加热的条件下会发生反应生成氯气;
(2)A中反应为硫酸与亚硫酸钠发生强酸制弱酸的反应;
(3)氯气属于有毒气体,可以用氢氧化钠溶液来吸收;
(4)亚铁离子和碘离子具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子;
(5)碘离子可以被氧化为单质碘,遇到淀粉变为蓝色;亚铁离子能被氧化为三价铁离子,遇到硫氰化钾显示红色;
(6)根据二氧化硫能否和碘单质间的反应可以判断二氧化硫和碘离子的还原性强弱;
(7)根据铁离子和二氧化硫之间的反应方程式进行计算.
解答 解:(1)二氧化锰和浓盐酸在加热的条件下会发生反应生成氯气,所以加热的仪器是C,
故答案为:C;
(2)A中反应为硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水,方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)氯气属于有毒气体,可以用氢氧化钠溶液来吸收,所以D中烧杯盛放的是氢氧化钠溶液,
故答案为:氢氧化钠溶液;
(4)亚铁离子和碘离子具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子,所以少量的氯气可以将碘离子氧化,离子反应为2I-+Cl2═I2+2Cl-,但是不能将亚铁离子氧化,
故答案为:2I-+Cl2═I2+2Cl-;
(5)碘离子可以被氧化为单质碘,碘单质遇到淀粉变为蓝色,据此可以用淀粉检验碘单质的产生,
故答案为:淀粉溶液;溶液呈蓝色;
(6)比较SO2和I-的还原性强弱,可以根据二氧化硫能否和碘单质间的反应来判断,所以可以关闭K2开K1,故答案为:A;
(7)铁离子和二氧化硫之间的反应实质是:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,根据铁元素守恒,铁离子的物质的量是0.05mol,所以消耗二氧化硫的物质的量是0.025mol,体积是:0.025mol×22.4L/mol=0.56L,
故答案为:0.56L.
点评 本题考查学生氯气的性质以及氧化还原反应的综合知识,属于综合知识的考查,侧重考查学生的分析问题的能力、审题能力和基本的计算能力,难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 放电时,锂为负极,发生还原反应 | |
| B. | 充电时阳极反应式为:8Li2S-16e-═S8+16Li+ | |
| C. | 电解质可采用导电有机电解质 | |
| D. | 锂硫电池的理论电压为2.0V,则单位质量的单质硫的比能量为3.35 kW•h/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 1.33 mol | C. | 2 mol | D. | 3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 丹参素在C上取代H的一氯代物有4种 | |
| B. | 在Ni催化下1mol丹参素最多可与4molH2加成 | |
| C. | 丹参素能发生取代、消去、中和、氧化等反应 | |
| D. | 1mol丹参素在一定条件下与足量金属钠反应可生成4molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
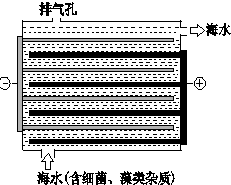 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.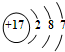 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1mol C12发生化学反应,转移的电子数一定为2NA | |
| D. | 在标准状况下,22.4L由N2、N2O组成的混合气体中所含有的氮原子为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com