
| 52.16% |
| 12 |
| 13.14 |
| 1 |
| 34.7% |
| 16 |
| 52.16% |
| 12 |
| 13.14 |
| 1 |
| 34.7% |
| 16 |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、②④⑤⑥⑦ |
| C、②③④⑥⑦⑧ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3→Al2O3 |
| B、Al2O3→Al(OH)3 |
| C、Al(OH)3→AlCl3 |
| D、AlCl3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||

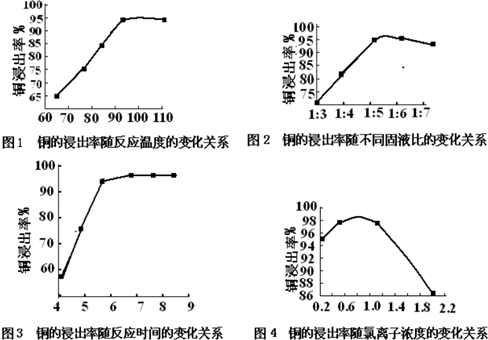
| 选项 | 反应温度/℃ | 固液比 | c(Cl-)/mol?L-1 | 反应时间/h |
| a | 100 | 1:5.5 | 0.7 | 7 |
| b | 95 | 1:5 | 0.8 | 6 |
| c | 110 | 1:6 | 0.9 | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
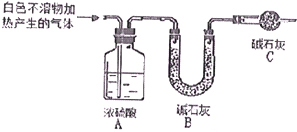 某研究性学习小组做实验做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体大量气体和白色不溶物,该小组同学通过如下实验,验证产物并探究反应原理.
某研究性学习小组做实验做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体大量气体和白色不溶物,该小组同学通过如下实验,验证产物并探究反应原理.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com