
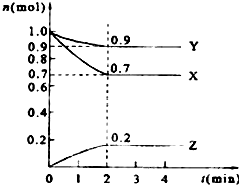
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. | △c |
| △t |
 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y 2Z;
2Z;
| ||
| 2min |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 性质 | A | B | C | D | E | F | G | M | I | J | K |
| 原子半径 (10-10m) | 1.02 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.54 | 0.75 | 1.17 | 1.34 |
| 最高价态 | +6 | +1 | --- | +3 | +4 | +5 | +7 | +1 | +5 | +4 | +1 |
| 最低价态 | -2 | --- | -2 | --- | -4 | -3 | -1 | --- | -3 | -4 | --- |
查看答案和解析>>
科目:高中化学 来源: 题型:
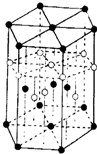 化学中的某些元素是与生命活动密不可分的元素.请回答下列问题:
化学中的某些元素是与生命活动密不可分的元素.请回答下列问题: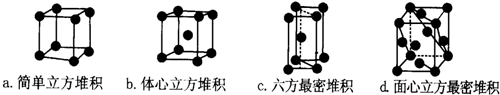
查看答案和解析>>
科目:高中化学 来源: 题型:
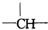 ,则该化合物的结构简式可能是(4种):
,则该化合物的结构简式可能是(4种):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜、酒精、冰醋酸分别属于非电解质、电解质、弱电解质 |
| B、煤的干馏、煤的液化都属于物理变化 |
| C、Fe(OH)3胶体和CuSO4溶液都是混合物 |
| D、冰醋酸、碱式碳酸铜、小苏打分别属于酸、碱、盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com