


科目:高中化学 来源: 题型:
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
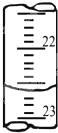 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积 | 标准烧碱体积 | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第一次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源:2012届福建省龙岩一中高三第一学段模块考试化学试卷 题型:实验题
(8分)某学生用0.2000 mol/L KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.将已用蒸馏水洗净的碱式滴定管,再用标准溶液润洗碱式滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3厘米 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第一学段模块考试化学试卷 题型:实验题
(8分)某学生用0.2000 mol/L KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.将已用蒸馏水洗净的碱式滴定管,再用标准溶液润洗碱式滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3厘米
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
G.检查酸式滴定管和碱式滴定管是否漏水
H.再重复做滴定实验2~3次,记录并处理数据。
就此实验完成以下填空:
(1)正确操作步骤的顺序是(用字母填写短缺的序号)
→ B → → C → → A→ → H
(2)判断到达滴定终点的实验现象是_ 。
(3)如果不进行B步骤的操作的则对滴定结果的影响是____ ______。(填“偏高”、“偏低”、“不影响”,下同)
(4)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(5)若用酸式滴定管取20.00 mL待测盐酸溶液时,取前有气泡,取后无气泡,其结果会导致测得待测盐酸溶液物质的量浓度 。
(6)若称量一定质量的KOH固体(含少量K2CO3)配制标准溶液并用来滴定上述盐酸,则对滴定结果的影响是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com