
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 氢氟酸具有酸性 | 氢氟酸可用于雕刻玻璃 |
| B | 氯水显酸性 | 可用pH试纸测氯水的pH |
| C | NH3极易溶于水 | NH3可用作制冷剂 |
| D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A.SiO2和HF反应生成四氟化硅与HF的酸性无关;
B.氯水含有次氯酸,次氯酸具有漂白性;
C.液氨气化时吸收热量导致其周围温度降低而作制冷剂;
D.强氧化性物质能使蛋白质变性而杀菌消毒.
解答 解:A.玻璃中含有二氧化硅,二氧化硅和HF发生反应SiO2+4HF=SiF4+2H2O,与HF的酸性无关,故A错误;
B.氯水含有次氯酸,次氯酸具有漂白性,氯水会把pH试纸漂泊,测不出氯水的pH值,故B错误;
C.液氨气化时吸收热量导致其周围环境温度降低,所以液氨可以作制冷剂,与氨气的溶解性大小无关,故C错误;
D.强氧化性物质能使蛋白质变性而杀菌消毒,ClO2具有强氧化性,可以杀菌消毒,故D正确;
故选D.
点评 本题考查物质的用途,明确物质的性质是解本题关键,性质决定用途,注意二氧化硅虽然属于酸性氧化物,但能和HF反应,注意二氧化硫漂白性和次氯酸漂白性的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | - |
| (2) | 0.1mol | 0.3mol | - | 0.2mol |
| A. | Cl-的物质的量相同 | B. | SO42-的数目相同 | ||
| C. | K+的数目相同 | D. | Zn2+的物质的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 | |
| B. | 铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| C. | 马口铁(镀锡铁)镀层破损后即失去保护作用 | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
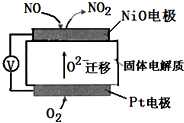 通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )
通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )| A. | Pt 电极上发生的是氧化反应 | |
| B. | O2-向正极迁移 | |
| C. | 负极的电极反应式为:NO-2e-+O2-=NO2 | |
| D. | 正极的电极反应式为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用农药化肥,减少病虫害,提高粮食产量 | |
| B. | 开发新能源,减少化石能源的使用 | |
| C. | 开发新型电池,推广废旧电池的回收、处理经验 | |
| D. | 用“绿色化学”工艺,使原料完全转化为目标产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
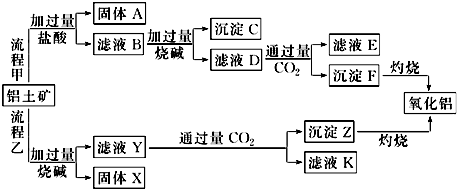
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的原子数目为NA.
的原子数目为NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
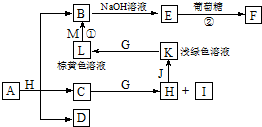 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com