
| 选项 | X | Y |
| a | SO2 | NO2 |
| b | C12 | CO2 |
| c | NH3 | CO2 |
| d | SO2 | H2S |
| ) |
| ) |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
| A、将煤液化或气化,获得清洁燃料 |
| B、提倡重拎布袋子、重提菜篮子,重复使用耐用型购物袋 |
| C、对垃圾进行无害化、资源化处理 |
| D、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、26.0kJ |
| B、51.9kJ |
| C、155.8kJ |
| D、467.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘水中萃取碘时,往分液漏斗中先后加入碘水和酒精,充分振荡静置后分液 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,应先从分液漏斗的下口放出下层液体,再从上口倒出上层液体 |
| D、蒸发时,当蒸发皿中的水只残留少许时,停止加热,利用余热将剩余水分蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol丙烷完全燃烧需4mol氧气 |
| B、与丁烷互为同分异构体 |
| C、能使酸性高锰酸钾溶液褪色 |
| D、分子式为C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
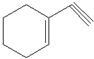 (1)某有机化合物分子结构式如图采取sp2杂化的C原子有
(1)某有机化合物分子结构式如图采取sp2杂化的C原子有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com