
20.A、B、C、D四种短周期元素,A、B为同周期元素,B、C同主族,B、C可形成共价化合物BC3 和BC2,A、D同主族,A的原子结构示意图如下图,据此填空:
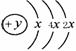 (1)A的元素名称为 。
(1)A的元素名称为 。
(2)A、B、C三种元素的原子,半径由小到大的顺序为 (用元素符号作答)。
(3)A、B和D最高价氧化物对应的水化物,酸性由强到弱的顺序为 (用对应酸的分子式作答,下同)。若用下图装置验证这三种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ ,Ⅱ ,Ⅲ 。
观察到的实验现象为 。
写出Ⅲ中现象对应的离子方程式 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2)∶n(NO)=1∶1时,下列说法正确的是 ( )
A.产物n[Cu(NO3)2]∶n[CuSO4]=1∶1
B.参加反应的n(Cu2S)∶n(HNO3)=1∶5
C.反应中Cu2S既作氧化剂,又作还原剂
D.1 mol Cu2S参加反应时转移8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到预期目的的是 ( )
A.将含有SO2的CO2气体通过足量的饱和Na2CO3溶液以除去SO2
B.称取19.0g氯化亚锡(SnCl2),用100mL蒸馏水溶解,配制1.0mol/LSnCl2溶液
C.用石墨作电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
D.测定NaCl和NaF溶液的pH值,确定F、Cl两元素非金属性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组粒子中质子数和电子数均相同的是
A.CH4、H2O、Na+ B.F2、Ar、HCl
C.H3O+、NH4+、Na D.O2-、Mg2+、Ne
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.同周期金属元素的化合价越高,其原子失电子能力越强
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,则该元素对应的气态氢化物稳定性越强
D.IA族与VIIA族元素间可形成共价化合物或离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
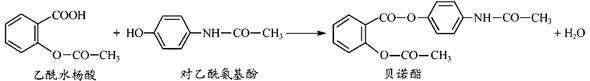
有关上述反应物和产物的叙述正确的是( )
A.按碳的骨架分类,上述三种有机物均属于芳香烃
B.乙酰水杨酸分子中不存在手性碳原子
C.在核磁共振氢谱中,对乙酰氨基酚分子有4个峰
D.贝诺酯分子中有3种不同类型的含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某元素M的原子的最外层电子排布是ns1,下列说法正确的是( )
A.M的最高价是+1价 B.M可能呈现出 -1价
C.M一定是s区元素 D.M一定是IA或IB族
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝单质的化学性质以相似为主,但也存在某些重大差异性,下列物质能用于证明二者存在较大差异性的是 ( )
①CO2 ②盐酸 ③NaOH溶液 ④水
A.①④ B.②③ C.①③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2。某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成。
(1)甲组同学取一定量燃烧后的固体投入水中,得到了一种能使湿润的红色 石蕊试纸变蓝的气体,该气体的化学式为______________________________,说明固体中含有Mg3N2,生成该气体的化学反应方程式为______________________________________________
石蕊试纸变蓝的气体,该气体的化学式为______________________________,说明固体中含有Mg3N2,生成该气体的化学反应方程式为______________________________________________
________________________________________________________________________。
(2)乙组同学为测定Mg3N2的含量,用下图所示装置进行实验,充分反应后再加热A。其中浓硫酸的作用是__________________________________________________________
__________________________,对A加热的目的是____________________________。
已知加入的固体质量为4.0 g,最终C装置增重a g,则固体中含Mg3N2______ g(用含a的式子表示)。
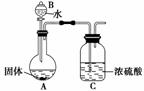
(3)丙组有的同学认为乙组同学的测定结果偏高,理由是
________________________________________________________________________
________________________________________________________________________。
有的同学认为乙组同学的测定结果偏低,理由是______________________________
________________________________________________________________________。
丙组同学进行了改进,他们将乙组同学实验中得到的难溶固体进行过滤、洗涤、干燥,并灼烧固体至恒重,测得其质量为4.08 g。上述过程中,洗涤沉淀的操作是________________________________________________________________________
________________________________________________________________________。
镁在空气中燃烧后生成的固体中Mg3N2的质量分数为______________。
(4)有一种用铵盐与含镁矿石混合煅烧制取氧化镁的方法,解决了现有方法存在的原料成本高、项目投资大、能耗高、副产品不好用等问题,其原理是将含镁矿石粉(含氧化镁)与铵盐混合,经过煅烧、水溶、过滤,得到粗镁盐溶液,并回收煅烧产生的氨。写出用固体(NH4)2SO4与含镁矿石粉混合煅烧时的化学反应方程式________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com