
| A. | 原子序数:a>b>d>c | B. | 原子半径:A>B>C>D | ||
| C. | 离子的还原性:D->C2- | D. | 气态氢化物的稳定性:H2C>HD |
分析 短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素,结合元素周期律解答.
解答 解:短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素.
A.核外电子数相等,所以有:a-3=b-1=c+2=d+1,则原子序数a>b>d>c,故A正确;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:B>A>C>D,故B错误;
C.同周期随原子序数增大非金属性增强,故非金属性O<F,则离子还原性:O2->F-,故C错误;
D.非金属性O<F,非金属性越强氢化物越稳定,故氢化物稳定性:HF>H2O,故D错误.
故选A.
点评 本题考查结构与位置关系、元素周期律等,难度中等,注意元素周期律的理解掌握,也可以根据电荷与核外电子排布相同推断元素在周期表中的位置而不需要推断具体的元素.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:推断题


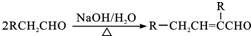
 .
.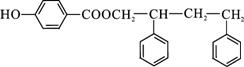 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯和油脂均不能使酸性KMnO4褪色 | |
| B. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 | |
| C. | 蒸馏和分馏都是通过沸点不同分离液态混合物的 | |
| D. | 油脂皂化反应的产物是高级脂肪酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
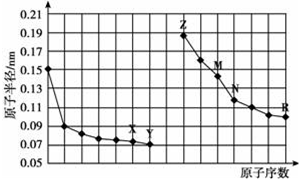
| A. | 简单离子的半径:X<Z<M | |
| B. | 最高价氧化物对应水化物的酸性:R<N | |
| C. | Y、R两种元素的气态氢化物稳定性:Y>R | |
| D. | 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
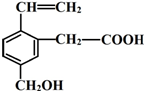 某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦
某有机物的结构简式如图,该物质不应有的化学性质是⑥⑦查看答案和解析>>
科目:高中化学 来源: 题型:解答题
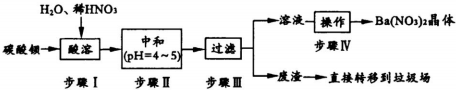
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com