
【题目】某兴趣小组采用以下装置进行铁粉和水蒸气的实验,并对反应后的产物进行探究.
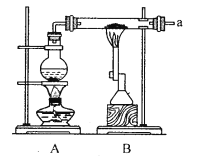
(1)铁粉与水蒸气反应的化学方程式为______;烧瓶中加入沸石的目的是_______
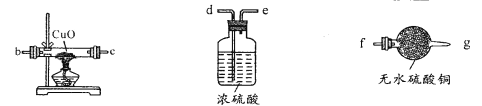
(2)用下图装置检验生成气体,连接顺序为(用字母表示)a![]() _______。
_______。
(3)证明反应后的固体中存在二价铁(限选试剂:1mol/LH2SO4、2mol/LHNO3、3%H2O2、0.01mol/LKMnO4、NaOH稀溶液、20%KSCN溶液、Fe2(SO4)3溶液)
步骤一:取反应后固体浸入Fe2(SO4)3溶液,充分反应后过滤并洗涤固体,其目的是_______;
步骤二:取过滤后所得固体加入过量_______,过滤;
步骤三:___________。
(4)取B中反应后的固体加足量稀硫酸溶解,再先后滴加KSCN溶液和氯水,溶液红色加深。请从平衡角度解释红色变深的原因_________。
【答案】 3Fe+4H2O(g)![]() Fe3O4+4H2 防止暴沸 d-e-b-c-f或d-e-c-b-f 利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰 1mol/LH2SO4 向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁 Cl2将溶液中的Fe2+氧化成Fe3+,使得Fe3++3SCN-
Fe3O4+4H2 防止暴沸 d-e-b-c-f或d-e-c-b-f 利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰 1mol/LH2SO4 向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁 Cl2将溶液中的Fe2+氧化成Fe3+,使得Fe3++3SCN-![]() Fe(SCN)3平衡正向移动,红色加深
Fe(SCN)3平衡正向移动,红色加深
【解析】(1)铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;反应需要加热,因此烧瓶中加入沸石的目的是防止暴沸;(2)由于反应生成的氢气中含有水蒸气,还原氧化铜之前需要干燥,最后用无水硫酸铜检验水的存在,则连接顺序为a-d-e-b-c-f或a-d-e-c-b-f。(3)步骤一:由于反应中铁过量,则取反应后固体浸入Fe2(SO4)3溶液充分反应后过滤并洗涤固体的目的是利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰;步骤二:溶解四氧化三铁时不能选择氧化性酸,则取过滤后所得固体加入过量1mol/LH2SO4,过滤;亚铁离子检验还原性,可以用酸性高锰酸钾溶液检验亚铁离子,则步骤三:向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁;(4)由于Cl2将溶液中的Fe2+氧化成Fe3+,铁离子浓度增大,使得平衡Fe3++3SCN-
Fe3O4+4H2;反应需要加热,因此烧瓶中加入沸石的目的是防止暴沸;(2)由于反应生成的氢气中含有水蒸气,还原氧化铜之前需要干燥,最后用无水硫酸铜检验水的存在,则连接顺序为a-d-e-b-c-f或a-d-e-c-b-f。(3)步骤一:由于反应中铁过量,则取反应后固体浸入Fe2(SO4)3溶液充分反应后过滤并洗涤固体的目的是利用Fe2(SO4)3溶液来氧化除去Fe单质,避免对后续实验造成干扰;步骤二:溶解四氧化三铁时不能选择氧化性酸,则取过滤后所得固体加入过量1mol/LH2SO4,过滤;亚铁离子检验还原性,可以用酸性高锰酸钾溶液检验亚铁离子,则步骤三:向滤液中加入适量0.01mol/L的KMnO4溶液,若溶液紫红色褪去,说明原产物中含有二价铁;(4)由于Cl2将溶液中的Fe2+氧化成Fe3+,铁离子浓度增大,使得平衡Fe3++3SCN-![]() Fe(SCN)3正向移动,因此红色加深。
Fe(SCN)3正向移动,因此红色加深。


科目:高中化学 来源: 题型:
【题目】下列冶炼金属的方法错误的是( )
A.电解熔融NaCl制钠
B.加热HgO制汞
C.高温下用CO还原Fe2O3制铁
D.高温下用H2还原Al2O3制铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为泡沫灭火器构造示意图,内筒a装有Al2(SO4)3溶液,外筒b装有饱和NaHCO3溶液。结合生活中的应用,下列分析错误的是

A. 使用时必须将泡沫灭火器倒立
B. 工作时HCO3-水解较彻底
C. 灭火时产生的Al(OH)3覆盖可燃物有利于阻隔氧气
D. 该灭火器可用于扑灭Na等金属着火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,氯离子浓度最大的是
A. 200mL 1molL-1NaCl溶液 B. 50mL 1.5molL-1AlCl3溶液
C. 100mL 0.8molL-1MgCl2溶液 D. 200mL 2molL-1KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上研究超导技术比较先进的国家,在高温超导材料中,铊(81Tl)是重要成分之,已知铊和铝是同主族元素,关于铊的性质推断错误的是
A.铊是银白色,质软的金属
B.铊不能形成稳定的气态氢化物
C.铊与浓硫酸反应生成T12(SO4)3
D.Tl(OH)3是两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,请计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和原溶液中溶质的物质的量浓度。
(3)在标准状况下生成H2的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 高级脂肪酸乙酯的碱性水解属于皂化反应
B. 蔗糖、淀粉、纤维素均为高分子化合物
C. 硫酸铜溶液可使蛋白质变性,可用于游泳池的杀菌消毒
D. 氨基酸分子中都含有-NO2 和-COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________。
(2)根据下表Cr原子的能级电离能(I:k]/mo1)数据,解释原子逐级电离能增大的原因:_______。
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____,N的杂化方式为________,写出NH3的一种等电子体___________。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.NaB.PoC.MgD.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏加德罗常数用NA表示,则Cr的原子半径是__pm.(写出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com