
一定温度下的密闭容器中,反应2SO2(g)+O2(g)⇌2SO3(g)达到平衡.缩小容器容积,对反应产生影响的叙述不正确的是()
A. 使平衡常数K增大
B. 使平衡向正反应方向移动
C. 使SO3的浓度增大
D. 使正反应速率大于逆反应速率
考点: 化学平衡的影响因素.
专题: 化学平衡专题.
分析: A.化学平衡常数只与温度有关;
B.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动;
C.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动,根据平衡移动方向确定三氧化硫浓度变化;
D.化学平衡向减弱相对反应速率大的方向移动.
解答: 解:A.该反应体系温度不变,则化学平衡常数不变,化学平衡常数只与温度有关,故A错误;
B.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动,所以平衡向正反应方向移动,故B正确;
C.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动,平衡向正反应方向移动,则生成物三氧化硫浓度增大,故C正确;
D.化学平衡向减弱相对反应速率大的方向移动,缩小容器容积,压强增大,平衡向气体体积缩小的方向移动,则正反应速率大于逆反应速率,故D正确;
故选A.
点评: 本题考查了压强对化学平衡的影响,注意压强只对反应前后气体体积改变的可逆反应平衡有影响,且化学平衡常数只与温度有关,与压强、浓度无关,为易错点.


科目:高中化学 来源: 题型:
溶液中可能有下列阴离子中的一种或几种:Cl﹣、OH﹣、CO32﹣、SO32﹣、SO42﹣.
(1)当溶液中有大量的H+存在时,不可能大量存在.
当溶液中有大量的Ba2+存在时,不可能大量存在 .
(3)当溶液中有大量的 存在时,上述所有阴离子都不可能大量存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为()
A. 大于2c mol/L B. 等于2c mol/L
C. 小于2c mol/L D. 在c mol/L∽2c mol/L之间
查看答案和解析>>
科目:高中化学 来源: 题型:
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是 、
(2)下列有关配制过程中说法错误的是 (填序号).
a.用电子天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90nL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br﹣被C12氧化成Br2溶解在溶液中; 假设2:Fe2+被C12氧化成Fe3+.
(1)请你完成表格,验证假设:
实验步骤、预期现象 结论
①溶液中加入适量四氯化碳 假设1正确
②向溶液中加入 假设2正确
若假设1正确,从实验①中分离出Br2的实验操作名称是 ;
(2)实验证明:还原性Fe2+>Br﹣,请用一个离子方程式来证明: ;
(3)若在50mL上述FeBr2溶液中通入5×10﹣3molCl2,反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 金属钠投入水中:Na+2H2O═Na++2OH﹣+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓
C. 铁和稀硝酸反应:Fe+2H+═H2↑+Fe2+
D. 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑+Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 0.1 mol.L﹣1 NaOH溶液:K+、Na+、SO42﹣、CO32﹣
B. 0.1 mol•L﹣1 Na2CO3溶液:K+、Ba2+、NO3﹣、Cl﹣
C. 0.1 mol•L﹣1 FeCl3溶液:K+、NH4+、I﹣、SCN﹣
D. 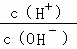 =1×l014的溶液:Ca2+、Na+、ClO﹣、NO3﹣
=1×l014的溶液:Ca2+、Na+、ClO﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
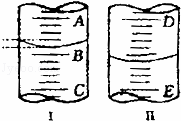
(如图)(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL.
(2)图Ⅱ表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
A.是a mL B.是(25﹣a)mLC.一定大于a mL D.一定大于(25﹣a)mL
(3)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7KJ/mol,
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=﹣534KJ/mol,
则肼与NO2完全反应的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com