
【题目】将溶质的质量分数为a%、物质的量浓度为c1 mol·L-1的稀硫酸加热蒸发掉一定量的水,使溶质的质量分数变为2a%,此时硫酸的物质的量浓度为c2 mol·L-1,则c1和c2的关系是( )
A.c2=2c1 B.c2>2c1 C.c2<2cl D.c1=2c2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( )
A. 168mL B. 224mL C. 504mL D. 336mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质<括号内为杂质)选用的试剂和分离方法部正确的是
物质 | 试剂 | 分离方法 | |
① | CuCl2(FeCl3) | CuO | 过滤 |
② | Cl2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
③ | 乙醇(水) | 金属钠 | 蒸馏 |
④ | NaCl溶液(Na2S) | AgCl | 过滤 |
A. ①③ B. ①④ C. 只有② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙是目前常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自燃。卫生安全标准规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg。某化学兴趣小组的同学通过下列方法对粮食中残留磷化物含量进行研究:
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸标准溶液滴定
【实验装置】
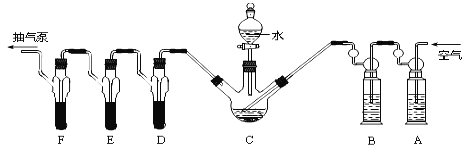
C中盛有200g原粮,D、E、F 各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4 溶液(H2SO4 酸化)。
请回答下列有关问题:
(1)仪器G的名称是 。以磷化铝为例,写出磷化铝与水反应的化学方程式 。
(2)检查C装置气密性的方法是:用止水夹夹紧C装置 ,取下上口活塞,漏斗中加入水,打开下口旋塞,观察到 ,表明装置气密性良好。
(3)实验过程中,用抽气泵反复抽气的目的是 。
(4)A中盛装KMnO4溶液是为除去空气中可能含有的 (填“还原”或“氧化”)性气体;B中盛装新制FeSO4溶液的作用是 ;
(5)已知 D、E、F 中发生同一反应,实验中 PH3被氧化成磷酸,写出所发生的化学反应方程式 ;收集装置D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4 mol/LNa2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为 mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列操作中,一般情况下不能相互接触的是( )
A. 过滤时,玻璃棒与三层滤纸
B. 分液时,分液漏斗下端与烧杯内壁
C. 过滤时,烧杯内壁与漏斗下端
D. 用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4︰4︰5︰1︰1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl。回答下列问题。
(1)元素D在周期表中的位置是 ,B原子的外围电子排布图为 。E原子的核外有 种不同运动状态的电子,B和C的第一电离能大小关系是 。(用元素符号表示)
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1︰1和l︰2,写出原子个数比为1︰1的化合物的电子式 ,两种化合物可以任意比互溶,解释其主要原因为 。
(3)该配位化合物的化学式为 。
(4)A元素与B元素可形成分子式为A2B2的化合物,该化合物的分子具有平面结构,则其结构式为 ,用电子式表示化合物Na2D的形成过程 。

(5)已知E的晶胞结构如图所示,此晶胞立方体的边长为a cm,E单质的密度为ρ g·cm-3,则阿伏伽德罗常数为 (用a、ρ表示)。该晶胞配位数为 ,EDC4常作电镀液,其中DC42-的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是
A.v(A)=0.9 mol /(L·s) B.v(B)=0.5 mol/(L·s)
C.v(C)=1.4 mol /(L·s) D.v(D)=1.8 mol /(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com