
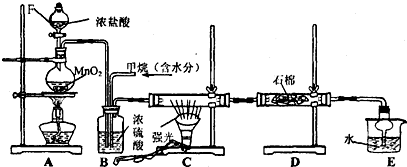
分析 A装置是用浓盐酸和二氧化锰加热制取氯气,B装置中氯气和甲烷充分混合,C装置在光照条件下氯气和甲烷发生取代反应生成氯代烃和HCl,D装置中的石棉上均匀附着湿润的KI粉末,氯气具有强氧化性,能氧化碘离子生成碘单质,HCl极易溶于水,可以用水吸收生成的HCl;
(1)在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水;
(2)B装置中含有浓硫酸,浓硫酸具有吸水性;该装置中氯气和甲烷充分混合;
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,说明有C生成,根据反应物、生成物及反应条件书写方程式;
(4)氯气具有强氧化性,能氧化还原性物质,E装置中水能吸收可溶性物质,且导致的干燥管能防止倒吸;
(5)互不相溶的液体可以采用分液方法分离提纯;
甲烷和一氯甲烷都是气体且不溶于水;
(6)氯气和甲烷发生取代反应生成氯代烃和HCl,HCl极易溶于水,氯气为黄绿色气体,氯代烃和甲烷都是无色物质,二氯甲烷、三氯甲烷、四氯化碳都是油状液体,HCl遇水蒸气生成盐酸小液滴.
解答 解:A装置是用浓盐酸和二氧化锰加热制取氯气,B装置中氯气和甲烷充分混合,C装置在光照条件下氯气和甲烷发生取代反应生成氯代烃和HCl,D装置中的石棉上均匀附着湿润的KI粉末,氯气具有强氧化性,能氧化碘离子生成碘单质,HCl极易溶于水,可以用水吸收生成的HCl;
(1)在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)B装置中含有浓硫酸,浓硫酸具有吸水性;该装置中氯气和甲烷充分混合,所以该装置的作用还有使气体混合均匀、干燥气体,
故答案为:使气体混合均匀;干燥气体;
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,说明有C生成,根据反应物、生成物及反应条件书写方程式为CH4+2Cl2$\stackrel{hv}{→}$ C+4HCl,故答案为:CH4+2Cl2$\stackrel{hv}{→}$ C+4HCl;
(4)氯气具有强氧化性,能氧化还原性物质KI,所以氯气的作用是吸收未反应的氯气,E装置中水能吸收可溶性物质,且导致的干燥管能防止倒吸,所以E装置作用是 吸收HCl,防止倒吸,
故答案为:吸收未反应的氯气; 吸收HCl,防止倒吸;
(5)互不相溶的液体可以采用分液方法分离提纯,二氯甲烷、三氯甲烷、四氯化碳都不溶于水,但HCl极易溶于水,可以采用分液方法分离提纯;
甲烷和一氯甲烷都是气体且不溶于水,所以还要处理尾气中的甲烷和一氯甲烷,
故答案为:分液;AB;
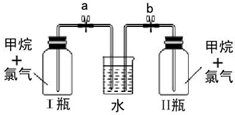
(6)氯气和甲烷发生取代反应生成氯代烃和HCl,HCl极易溶于水,氯气为黄绿色气体,氯代烃和甲烷都是无色物质,二氯甲烷、三氯甲烷、四氯化碳都是油状液体,HCl遇水蒸气生成盐酸小液滴,所以看到I中的现象是颜色逐渐变浅,且有油状液体产生,出现白雾,并可以看见水倒吸入I瓶中,
故答案为:在I瓶中:颜色逐渐变浅,且有油状液体产生,出现白雾,并可以看见水倒吸入I瓶中.
点评 本题考查物质制备,为高频考点,明确物质性质、化学反应原理水解本题关键,侧重考查学生实验操作、物质分离提纯、物质性质,难点是判断B装置的作用,“气体在该装置中混合均匀“很多学生回答不出来.


科目:高中化学 来源: 题型:选择题
| A. | 2molSO2(g)和1mol O2(g)所具有的键能总和大于2 molSO3(g)所具有的键能总和 | |
| B. | 将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 相对分子质量 | 性质 |
| 废饮料瓶碎片 | 聚对苯二甲酸乙二醇酯:乳白色或浅黄色的聚合物. | |
| 乙二醇(EG) | 62 | 无色无臭液体,对动物有毒性.沸点:196~198℃,与水混溶. |
对苯二甲酸(TPA) | 166 | 白色晶体或粉末,低毒.弱酸.300℃以上升华.不溶于水、乙醚、氯仿等大多数有机溶剂,可溶于DMF等强极性有机溶剂. |
 .
. ,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.
,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
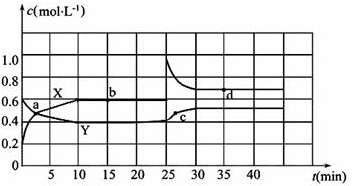
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
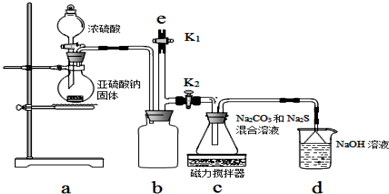
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com