
写出用惰性电极电解下列电解质溶液的电极反应式及电解反应的化学方程式
(1)Ba(OH)2:____________________________________________________________;
(2)Na2CO3: __________________________________________________________;
(3)KCl: ____________________________________________________________;
(4)AgNO3: ___________________________________________________________。
科目:高中化学 来源: 题型:
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)====2HCl(g) ΔH=-185 kJ·mol-1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为_________。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是__________。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)====CH4(g)的反应热ΔH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
(1)H2(g)+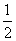 O2(g)===H2O(g) ΔH1=a kJ·mol-1
O2(g)===H2O(g) ΔH1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
(3)H2(g)+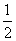 O2(g)===H2O(l) ΔH3=c kJ·mol-1
O2(g)===H2O(l) ΔH3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图装置测定中和热的实验步骤如下:
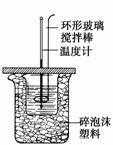
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):________________________________________________________________________
________________________________________________________________________。
(2)倒入NaOH溶液的正确操作是______(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______(从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温 度t2/℃ | 温度差平均值(t2-t1) /℃ | |
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
②近似认为0.55 mol·L-1 NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=
________________________________________________________________________
( 取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)
____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
能用电解原理说明的问题是( )
①电解是把电能转变成化学能 ②电解是化学能转变成电能 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必须导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是学习化学的重要工具,右图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )
A.该元素的名称是钠
B.该元素的原子序数为11
C.该元素在地壳中的含量为22.99%
D.该元素的元素符号为Na

查看答案和解析>>
科目:高中化学 来源: 题型:
美国劳伦斯·利弗莫尔国家实验室成功合成了118号超重元素,并观察到其存在了不到1毫秒时间。该元素符号为:Uuo,质量数为293,以下叙述不正确的是( )
A.该元素原子核外含有118个电子,核内有175个中子
B.该元素属于第7周期
C.该元素一定是一种金属元素
D.该元素位于0族
查看答案和解析>>
科目:高中化学 来源: 题型:
诺贝尔化学奖获得者施罗克等人发现,金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2+7O2====2MoO3+4SO2;
②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;
④H2MoO4 MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是( )
A.反应①和⑤都属于置换反应
B.进行②③④步反应的目的是提纯MoO3
C.在反应①中Mo和S均被氧化
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量之比为2∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化不是由加成反应引起的是 ( )
A.苯中加溴水振荡,溴水层褪色
B.烯烃通入溴的CCl4溶液中褪色
C.乙烯在一定条件下生成乙烷
D.苯转化为环己烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com