

 (不考虑空间构型,如有配位键,请标出)
(不考虑空间构型,如有配位键,请标出)分析 Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,则Z为Cu元素,其余的均为短周期主族元素;
Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素;
Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,其原子序数大于O元素,小于Cu元素,故Y为Si元素;
R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,
再结合题目分析解答.
解答 解:Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,则Z为Cu元素,其余的均为短周期主族元素;
Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,则X为O元素;
Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,其原子序数大于O元素,小于Cu元素,故Y为Si元素;
R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,
(1)C、N、O、Si、Cu元素基态时未成对电子数分别是2、3、2、2、1,所以五种元素原子中基态时未成对电子数最多的是N元素,故答案为:N;
(2)Y是Si元素,其1s、2s、2p、3s、3p能级分别有2、2、6、2、2个电子,基态原子Si的轨道表示式是: ,
,
故答案为: ;
;
(3)Z是Cu元素,其原子核外有29个电子,根据构造原理知,基态原子Cu的电子排布式是1s22s22p63s23p63d104s1,向Z的硫酸盐溶液中加入过量氨水时生成铜铵络离子,反应的离子方程式是Cu 2++4NH3.H2O=Cu(NH3)42++4H2O,配合物离子[Cu(NH3)4]2+中的配位键为 ;
;
故答案为:1s22s22p63s23p63d104s1;Cu 2++4NH3.H2O=Cu(NH3)42++4H2O; ;
;
(4)Q、R、X分别是C、N、O元素,同一周期元素,其电负性随着原子序数增大而增大,所以Q、R、X的电负性由小到大的顺序是C、N、O,故答案为:C、N、O;
(5)Q、X和Y分半是C、O、Si元素,元素的非金属性越强,其氢化物的稳定性越强,非金属性O>C>Si,所以Q、X、Y的氢化物稳定性由小到大的顺序为SiH4<CH4<H2O,故答案为:SiH4<CH4<H2O;
(6)在一定条件下,原子从能量高的能级跃迁到能量低的能级时放出能量,所以原子的核外电子从激发态跃迁到基态产生的光谱属于发射光谱(填“吸收”或“发射”),该光谱可用于鉴定元素,
故答案为:发射;鉴定.
点评 本题考查物质结构和性质相互关系及应用,为高频考点,涉及元素周期律、配合物结构、原子核外电子排布等知识点,综合性较强,侧重考查学生知识综合运用能力,注意配位键的表示方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在 | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 加入Ba(NO3)2,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 | |
| D. | 用洁净的铂丝蘸取溶液放在火焰上灼烧,观察到火焰呈黄色,可确定有Na+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b+c | B. | a=b-c | C. | a=c-b | D. | c=a+b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+[:$\underset{\stackrel{••}{Cl}}{••}$:]2- | B. | Na+[$\stackrel{•}{X}$$\underset{\stackrel{••}{S}}{••}$$\stackrel{•}{X}$]-2Na+ | ||
| C. | [Mg2+][$\underset{X}{•}$$\underset{\stackrel{••}{O}}{••}$$\underset{X}{•}$]2- | D. | K+[$\stackrel{•}{X}$$\underset{\stackrel{••}{F}}{••}$:]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
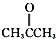 ③CH3CH2Br ④
③CH3CH2Br ④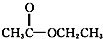 ⑤
⑤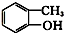
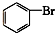 ⑦
⑦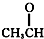 ⑧
⑧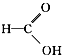 ⑨
⑨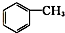 ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
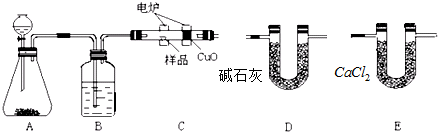
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(a-b)kJ•mol-1 | B. | -(a+b)kJ•mol-1 | ||
| C. | -(5a-0.5b)kJ•mol-1 | D. | -(0.5a-5b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
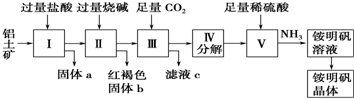
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
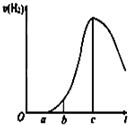 某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.
某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com