
【题目】下列关于常见化学物质的应用不正确的是( )
A.干冰能用作冷冻剂
B.明矾可用作净水剂
C.味精可用作食品调味剂
D.苏打是一种膨松剂,可用于制作馒头和面包
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】变量控制是科学研究的重要方法。相同质量的碳酸钙与足量1 mol·L-1盐酸分别在下列条件下发生反应,化学反应速率最大的是
选项 | 碳酸钙的状态 | 实验温度/℃ |
A | 粉末 | 10 |
B | 粉末 | 30 |
C | 块状 | 10 |
D | 块状 | 30 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
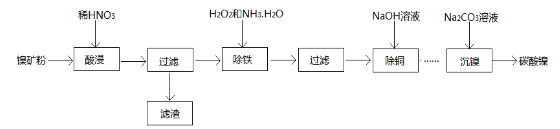
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把等量金属钠进行下列实验,其中生成氢气最多的是
A.把钠放入足量稀盐酸中B.把钠放入足量水中
C.把钠放入硫酸铜溶液中D.将钠用铝箔包好并刺些小孔,再放入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K= ![]()
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用废弃的铁铝混合物(含Fe、Al、Al2O3、Fe2O3)回收金属铝和铁,实验流程设计如下:
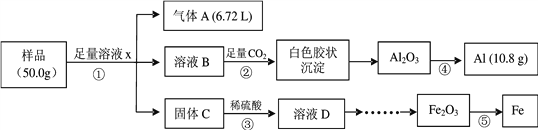
(1)写出①中发生反应的离子方程式___________、_____________。
(2)下列说法正确的是_________。
a. ②中发生的是非氧化还原反应
b. ③中所得溶液D中含有Fe2+和Fe3+
c. ④和⑤分别采用电解法和热还原法
(3)由溶液D制取Fe2O3的实验过程是 ______________。
(4)该样品中Al2O3的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)Fe(s)+CO2(g)△H>0
试回答下列问题:
(1)写出该反应的平衡常数表达式 .
(2)升高温度,该反应的平衡常数K值将(填“增大”、“减小”、“不变”),平衡体系中固体的质量将( 填“增大”、“减小”、“不变”).
(3)已知1100℃时该反应的平衡常数K=0.263.在该温度测得高炉中c(CO2)=0.025molL﹣1 , c(CO)=0.1molL﹣1 , 此时该的化学反应速度是v(正) (填“>”、“<”、“=”)v(逆).
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值(填”>”、“<”、“=”)0.263.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定含Cu2+B.溶液中一定含Fe2+
C.剩余固体一定含CuD.加入KSCN溶液一定不变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com