
 实验室通常用如右图所示的装置来制取氨气.回答下列问题:
实验室通常用如右图所示的装置来制取氨气.回答下列问题:分析 (1)实验室用加热氯化铵和氢氧化钙反应制备氨气;
(2)依据氨气极易溶于水的物理性质解答;
(3)氨气与氯化氢反应生成白色固体氯化铵.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)收集氨气时,使用的试管(或集气瓶)必须干燥,因为氨气极易溶于水,1体积水溶解700体积氨气;
故答案为:氨气极易溶于水;
(3)氨气与氯化氢反应生成白色固体氯化铵,所以会产生大量白烟;
故答案为:白烟.
点评 本题考查了氨气的制备及性质检验,明确氨气制备原理和氨气的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯和2-甲基-1-丁烯 | B. | 己烷和环己烷 | ||
| C. | 尿素CO(NH2)2和氰酸铵 (NH4CNO) | D. | 乙苯和丙苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
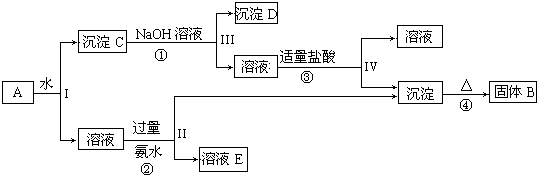
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
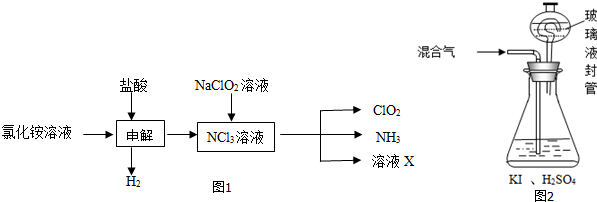
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中反应生成NH3(g),反应达到平衡时放出的热量为7.72kJ,其热化学方程式为:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H<0,升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 100ml 1mol/L的FeCl3溶液中Fe3+数目为0.1NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
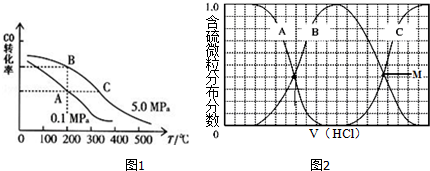
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A. | 四种溶液中,Na2CO3溶液中水的电离程度最大 | |
| B. | 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度 | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com