
| A. | 氧化铜跟硝酸反应 Cu2++O2-+2H+═Cu+H2O | |
| B. | 碳酸镁跟硝酸反应 CO32-+2H+═CO2↑+H2O | |
| C. | 铜跟稀硝酸反应 Cu+4H++NO3-═Cu2++NO↑+2H2O | |
| D. | 铁跟浓硝酸共热 Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
分析 A.氧化铜为氧化物,离子方程式中不能拆开;
B.碳酸镁为难溶物,离子方程式中不能拆开;
C.离子方程式两边不满足电荷守恒、电子守恒.
D.铁与浓硝酸在加热条件下反应生成硝酸铁、二氧化氮气体和水.
解答 解:A.氧化铜不能拆开,氧化铜与稀硝酸反应的离子方程式为:CuO+2H+=Cu2++H2O,故A错误;
B.碳酸镁需要保留化学式,正确的离子方程式为:MgCO3+2H+=Mg2++CO2↑+H2O,故B错误;
C.铜与稀硝酸反应生成硝酸铜、NO气体和水,正确的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故C错误;
D.铁与浓硝酸在常温下发生钝化,在加热条件下反应生成硝酸铁、二氧化氮气体和水,反应的离子方程式为:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:解答题
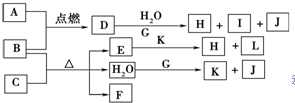 如图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,H为红褐色沉淀,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.
如图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,H为红褐色沉淀,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时电解质溶液的密度减小 | B. | 放电时K+向Cd极区移动 | ||
| C. | 充电时阳极Cd元素被氧化 | D. | 充电时阴极附近的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
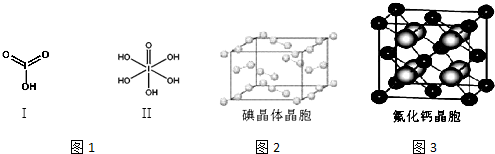
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +NaOH$\stackrel{H_{2}O}{→}$
+NaOH$\stackrel{H_{2}O}{→}$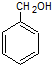 +NaCl,反应类型为取代反应.
+NaCl,反应类型为取代反应. .
. .
.
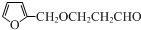

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行蒸发操作时,当溶液中出现较多固体时即可停止加热 | |
| B. | 进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 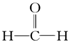 醛类 醛类 | B. | 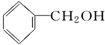 酚类-OH 酚类-OH | C. |  醛类 醛类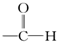 | D. | CH3COOCH3羧酸类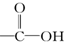 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com